
選擇一種溶劑將碘水中的碘萃取出來,這種溶劑應該具有的性質
A.易溶于水,且不與碘發生反應 B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且密度必須比水大 D.不溶于水,且密度必須比水小
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016-2017學年河北省高二上10月檢測化學卷(解析版) 題型:選擇題
下列有關說法正確的是
A.放熱反應在任何條件都能自發進行
B.應用蓋斯定律,可計算某些難以直接測量的反應焓變
C.在鐵制品上鍍銅時,鍍件為陽極,銅鹽為電鍍液
D.電解精煉銅時,外電路中轉移電子數為2NA個時,陽極銅質量減少64g
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高二上10月月考化學卷(解析版) 題型:選擇題
在0.1 mol·L-1 CH3COOH溶液中存在如下電離平衡:CH3COOH CH3COO-+H+。對于該平衡,下列敘述正確的是 ( )
CH3COO-+H+。對于該平衡,下列敘述正確的是 ( )
A.加入水時,平衡向逆反應方向移動
B.加入少量冰醋酸,平衡向正反應方向移動,電離程度減小
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)減小
D.加入少量CH3COONa固體,平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高二上10月月考化學卷(解析版) 題型:選擇題
已知強酸與強堿的稀溶液發生中和反應的熱化學方程式為H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向0.1 L 0.2 mol·L-1的NaOH溶液中加入下列物質:①稀醋酸;②濃硫酸;③稀鹽酸,恰好完全反應。則其焓變ΔH1、ΔH2、ΔH3的關系是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1>ΔH3>ΔH2 C.ΔH1=ΔH3>ΔH2 D.ΔH1<ΔH3<ΔH2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年貴州遵義航天中學高一上月考一化學卷 (解析版) 題型:填空題
以物質的量為中心的相關計算,已知阿伏伽德羅常數為NA.
(1)質量相同的H2、NH3、SO2、O3四種氣體中,含有分子數目最少的是___________,在相同溫度和相同壓強條件下,體積最大的是___________。
(2)73.0g HCl氣體中含有_______個分子、________個原子、______個質子、_________個電子,標況下體積約為_______L
(3)23.75 g某+2價金屬的氯化物(MCl2)中含有3.01×1023個Cl-,則MCl2的摩爾質量為________, MCl2的相對分子質量為________,M的相對原子質量為________。
(4)將0.5L1mol/L FeCl3溶液加水稀釋至1L,所得溶液中氯離子的物質的量濃度是________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省高二上月考一化學試卷(解析版) 題型:實驗題
化學反應速率是描述化學反應進行快慢程度的物理量。下面是某同學測定化學反應速率并探究其影響因素的實驗。
Ⅰ.測定化學反應速率
該同學利用如圖裝置測定化學反應速率。(已知:S2O32-+2H+ = H2O+S↓+SO2↑)
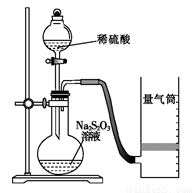
(1) 為保證實驗準確性、可靠性,利用該裝置 進行實驗前應先進行的步驟是 ;除如圖所示的實驗用品、儀器外,還需要的一件實驗儀器是______ 。
進行實驗前應先進行的步驟是 ;除如圖所示的實驗用品、儀器外,還需要的一件實驗儀器是______ 。
(2)若在2 min時收集到224 mL(已折算成標準狀況)氣體,可計算出該2 min內H+的反應速率,而該測定值比實際值偏小,其原因是 。
(3)試簡述測定該反應的化學反應速率的其他方法(寫一種):
Ⅱ.為探討化學反應速率的影響因素,設計的實驗方案如下表。
(已知 I2+2S2O32- = S4O62-+2I-,其中Na2S2O3溶液均足量)
實驗序號 | 體積V/mL | 時間/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0[ | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)該實驗進行的目的是 ,表中Vx= mL,比較t1、t2、t3大小,試推測該實驗結論:
查看答案和解析>>
科目:高中化學 來源:2016-2017學年甘肅省高二上月考一化學試卷(解析版) 題型:選擇題
在恒溫恒壓的密閉容器中,充入 4L X和3L Y的混合氣體,在一定條件下發生下列反應:4X(g)+3Y(g) 2Q(g)+nR(g)達到平衡時測得 X的轉化率為25%,此時混合氣體的體積為6.5L。則該反應方程式中的n值是( )
2Q(g)+nR(g)達到平衡時測得 X的轉化率為25%,此時混合氣體的體積為6.5L。則該反應方程式中的n值是( )
A.3 B.5 C.6 D.8
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省高二上月考一化學試卷(解析版) 題型:選擇題
向容積固定為2L的密閉容器中充入9.6mol NO和4.8molO2,發生如下反應:
①2NO(g)+O2(g) 2NO2(g) △H<0
2NO2(g) △H<0
②2NO2(g) N2O4(g) △H<0
N2O4(g) △H<0
測得反應達到平衡時NO2濃度為1.2 mol/L,N2O4的濃度為0.8 mol/L。則反應①的化學平衡常數為( )
A. 0.24 B.0.36 C.1.44 D.l.96
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上月考一化學試卷(解析版) 題型:實驗題
在學習《常見的堿》課題時,某化學小組在實驗室發現一瓶的試劑瓶底有一些白色固體物質。課后同學們對這瓶石灰水是否變質進行了探究。
[提出猜想]甲同學認為:石灰水完全變質;乙同學認為:石灰水部分變質;
丙同學認為:____________。
[實驗方案]

[分析與討論]
大家通過分析和討論認為:如果丙同學的猜想也正確,則瓶底的白色固體物質是____________(填化學式),其產生的原因是(用化學方程式表示)____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com