
分析 (1)石灰石、二氧化硫、氧氣和水反應生成生石膏的反應為2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g),根據蓋斯定律,該反應等于①×2+②×2+③,計算△H;
(2)氮氧化物與氨氣發生的反應是氧化還原反應,氮氧化物把氨氣氧化為氮氣,本身被還原為氮氣,可以利用反應方程式通過設未知列方程組計算;也可以根據氧化還原反應的電子守恒計算;也可以利用平均值法計算;
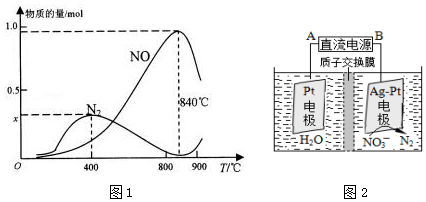
(3)①在上述1L的密閉容器中加入l mol NH3和1.5mol O2的反應過程中還發生4NH3+3O2?N2+6H2O反應,400℃時,混合氣體中NH3、N2、NO的物質的量比為5:6:3,結合氮元素守恒計算x;
②氨氣和氧氣的反應為放熱反應,溫度高于840℃后,各物質的物質的量發生變化,NO減小,氮氣增加,結合化學平衡影響因素分析判斷;
(4)陰極反應是NO3-得電子發生還原反應生成N2,利用電荷守恒與原子守恒知有水生成;轉移2mol電子時,陽極(陽極反應為H2O失電子氧化為O2和H+)消耗1mol水,產生2molH+進入陰極室,陽極室質量減少18g;陰極室中放出0.2molN2(5.6g),同時有2molH+(2g)進入陰極室.
解答 解:(1)石灰石、二氧化硫、氧氣和水反應生成生石膏的反應為2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g),根據蓋斯定律,該反應等于①×2+②×2+③,計算△H=+178.2×2+(-402)×2+(-234.2)=-681.8kJ/mol,
故答案為:2CaCO3(s)+O2(g)+2SO2(g)+4H2O(l)?2[CaSO4.2H2O](s)+2CO2(g)△H=-681.8kJ/mol;
(2)根據反應可知:氨氣被氧化為氮氣,NH3~N2~3e-;一氧化氮被還原為氮氣,NO~N2~2e-二氧化氮被還原為氮氣NO2~N2~4e-
設一氧化氮體積為x,二氧化氮體積為3-x,氨氣的體積為3.5L,根據電子守恒可知:3.5L×3=2x+4×(3-x),x=0.75L,二氧化氮體積為2.25L,則相同條件下,混合氣體中NO和NO2的體積比等于物質的量之比=0.75:2.25=1:3;
故答案為:1:3;
(3)①在上述1L的密閉容器中加入l mol NH3和1.5mol O2的反應過程中還發生4NH3+3O2?N2+6H2O反應,已知400℃時,混合氣體中NH3、N2、NO的物質的量比為5:6:3,結合氮元素守恒計算,5y+6y×2+3y=1
y=0.05
氮氣物質的量=6y=0.05mol×6=0.3mol,
x=0.3
故答案為:0.3;
②上述計算分析可知,NH3生成NO和N2的反應分別屬于放熱反應,溫度高于840℃后,各物質的物質的量發生如圖所示變化,NO減小,N2物質的量增大,可能是氨氣高溫分解生成氮氣和氫氣,使氨氣氧化生成NO平衡向左移動;NO高溫分解生成氮氣和氧氣;氨氣和NO反應生成氮氣和水,
故答案為:放熱反應;可能是氨氣高溫分解生成氮氣和氫氣,使氨氣氧化生成NO平衡向左移動;NO高溫分解生成氮氣和氧氣;氨氣和NO反應生成氮氣和水;
(4)在陰極反應是NO3-得電子發生還原反應生成N2,利用電荷守恒與原子守恒知有H2O生成,所以陰極上發生的電極反應式為:2NO3-+12 H++10e-=N2↑+6H2O,轉移2mol電子時,陽極(陽極反應為H2O失電子氧化為O2和H+)消耗1mol水,產生2molH+進入陰極室,陽極室質量減少18g;陰極室中放出0.2molN2(5.6g),同時有2molH+(2g)進入陰極室,因此陰極室質量減少3.6g,故膜兩側電解液的質量變化差(△m左-△m右)=18g-3.6g=14.4g,
故答案為:2NO3-+12 H++10e-=N2↑+6H2O;14.4.
點評 本題考查電解原理、電極反應式書寫、電解計算等知識點,要注意該題中陰極室有氫離子進入,易漏掉,為易錯點.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
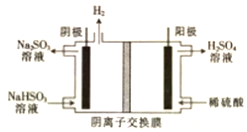 電解原理在工業生產中應用廣泛.
電解原理在工業生產中應用廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
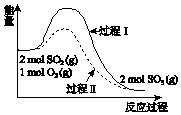 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反應能量變化如圖所示.下列說法中,不正確的是( )
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反應能量變化如圖所示.下列說法中,不正確的是( )| A. | a<0 | |
| B. | 過程II可能使用了催化劑 | |
| C. | 使用催化劑可以提高SO2的平衡轉化率 | |
| D. | 反應物斷鍵吸收能量之和小于生成物成鍵釋放能量之和 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 電解質溶液的電導率越大,導電能力越強.用0.100mol/L的NaOH溶液滴定10.00mL濃度均為0.100mol/L的鹽酸和CH3COOH溶液.利用傳感器測得滴定過程中溶液的電導率如圖所示.下列說法不正確的是( )
電解質溶液的電導率越大,導電能力越強.用0.100mol/L的NaOH溶液滴定10.00mL濃度均為0.100mol/L的鹽酸和CH3COOH溶液.利用傳感器測得滴定過程中溶液的電導率如圖所示.下列說法不正確的是( )| A. | 曲線①代表滴定CH3COOH溶液的曲線 | |
| B. | A、C兩點對應溶液均呈中性 | |
| C. | B點溶液中:c(Na+)>c(OH-)>c(CH3COO-) | |
| D. | A點溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
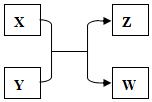 X、Y、Z、W四種物質有如下相互轉化關系(其中X、W為單質,Y、Z為化合物,未列出反應條件).
X、Y、Z、W四種物質有如下相互轉化關系(其中X、W為單質,Y、Z為化合物,未列出反應條件).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com