
| A. | 水電離出的c(OH-):①>②>④>③ | |
| B. | ①和③混合后溶液呈中性:c(Na+)+c(H+)>c(CH3COO-)+c(Cl-) | |
| C. | ①和④混合后溶液呈酸性:$\frac{c(N{a}^{+})}{c(C{H}_{3}CO{O}^{-})}$=1 | |
| D. | ③和④分別稀釋100倍后的pH④<③ |
分析 A、對于①0.1mol•L-1CH3COONa溶液,②pH=13的NaOH溶液,③pH=1的HC1溶液,④0.1mol•L-1CH3COOH溶液,只有醋酸鈉會促進水的電離,其余都會抑制水的電離;
B、0.1mol•L-1CH3COONa溶液和pH=1的HC1溶液混合,得到的溶液遵循電荷守恒,據此回答;
C、0.1mol•L-1CH3COONa溶液和0.1mol•L-1CH3COOH溶液中存在2c(Na+)=c(CH3COO-)+c(CH3COOH),但是c(CH3COO-)≠c(CH3COOH);
D、pH=1的HC1的氫離子濃度大于0.1mol/L醋酸的濃度.
解答 解:A、對于①0.1mol•L-1CH3COONa溶液,②pH=13的NaOH溶液,③pH=1的HC1溶液,④0.1mol•L-1CH3COOH溶液,只有醋酸鈉會促進水的電離,其余都會抑制水的電離,水電離出的c(OH-):①>④>②=③,故A錯誤;
B、0.1mol•L-1CH3COONa溶液和pH=1的HC1溶液混合,得到的溶液遵循電荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),所以c(Na+)=c(CH3COO-)+c(Cl-),c(Na+)+c(H+)>c(CH3COO-)+c(Cl-),故B正確;
C、0.1mol•L-1CH3COONa溶液和0.1mol•L-1CH3COOH溶液中存在2c(Na+)=c(CH3COO-)+c(CH3COOH),但是c(CH3COO-)≠c(CH3COOH),所以鈉離子和醋酸根離子濃度不相等,故C錯誤;
D、pH=1的HC1的氫離子濃度大于0.1mol/L醋酸的濃度,分別稀釋100倍后,pH:④>③,故D錯誤.
故選B.
點評 本題考查學生溶液中離子濃度之間的守恒關系、水的電離以及算的稀釋等方面的知識,屬于綜合知識的考查,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Na2SO4、BaCl2、NaNO3、NaCl | B. | AgNO3、CaCl2、KNO3、MgCl2 | ||
| C. | Na2SO4、Na2CO3、BaCl2、HCl | D. | NaOH、BaCl2、KNO3、Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AlCl3溶液與燒堿溶液反應,當n(OH-):n(Al3+)=7:2時,2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O | |
| B. | 向飽和Na2CO3溶液中通入過量的CO2:CO32-+CO2+H2O=2HCO3- | |
| C. | CuCl2溶液與NaHS溶液反應,當n(CuCl2):n(NaHS)=1:2時,Cu2++2HS-=CuS↓+H2S↑ | |
| D. | Fe與稀硝酸反應,當n(Fe):n(HNO3)=1:2時,3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.2 mol/L | B. | 0.3mol/L | C. | 0.4 mol/L | D. | 0.5 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C4H10和C20H42 | B. | 一溴乙烷和1,2-二溴乙烷 | ||
| C. | 鄰二甲苯和對二甲苯 | D. | C4H8和C3H6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 項目 | 結論 |
| A | 三種有機化合物:乙烷、氯乙烯、苯 | 分子內所有原子均在同一平面上 |
| B | C4H8Cl2的同分異構體數目(不考慮立體異構) | 共有10種 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均屬于取代反應 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
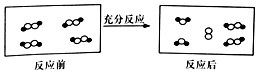 一定條件下,某容器中各微粒在反應前后變化的示意圖如圖,其中•和○代表不同元素的原子.關于此反應說法正確的是( )
一定條件下,某容器中各微粒在反應前后變化的示意圖如圖,其中•和○代表不同元素的原子.關于此反應說法正確的是( )| A. | 屬于化合反應 | B. | 屬于置換反應 | ||
| C. | 屬于氧化還原反應 | D. | 屬于復分解反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com