
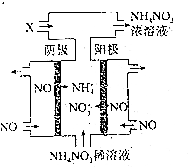
分析 工業(yè)上電解NO制備N(xiāo)H4NO3,陽(yáng)極發(fā)生氧化反應(yīng),NO被氧化生成NO3-,陰極發(fā)生還原反應(yīng),NO被還原生成NH4+,陽(yáng)極反應(yīng)為NO-3e-+2H2O=NO3-+4H+,陰極反應(yīng)為:NO+5e-+6H+=NH4++H2O,總反應(yīng)方程式為:8NO+7H2O$\frac{\underline{\;電解\;}}{\;}$3NH4NO3+2HNO3,據(jù)此解答.
解答 解:工業(yè)上電解NO制備N(xiāo)H4NO3,陽(yáng)極發(fā)生氧化反應(yīng),NO被氧化生成NO3-,陰極發(fā)生還原反應(yīng),NO被還原生成NH4+,陽(yáng)極反應(yīng)為NO-3e-+2H2O=NO3-+4H+,陰極反應(yīng)為:NO+5e-+6H+=NH4++H2O,總反應(yīng)方程式為:8NO+7H2O$\frac{\underline{\;電解\;}}{\;}$3NH4NO3+2HNO3,因此若要使電解產(chǎn)物全部轉(zhuǎn)化為NH4NO3,需補(bǔ)充N(xiāo)H3,通入的X物質(zhì)的化學(xué)式是NH3,
電解生成硝酸銨與硝酸,而硝酸與氨氣轉(zhuǎn)化為硝酸銨,電源提供15mol電子,生成NO3-為$\frac{15mol}{3}$=5mol,由硝酸根守恒,理論上最多制備N(xiāo)H4NO3的物質(zhì)的量為5mol,
故答案為:NO-3e-+2H2O=NO3-+4H+;NH3;5mol.
點(diǎn)評(píng) 本題考查電解原理,側(cè)重于考查學(xué)生的綜合運(yùn)用能力,計(jì)算制備硝酸銨物質(zhì)的量為易錯(cuò)點(diǎn),難度中等,注意基礎(chǔ)知識(shí)的積累掌握.


 閱讀快車(chē)系列答案
閱讀快車(chē)系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | CaCl2溶液 | B. | 澄清石灰水 | C. | 稀鹽酸 | D. | 酚酞溶液 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
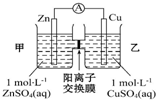
| A. | 銅電極上發(fā)生反應(yīng)Cu-2e-=Cu2+ | |
| B. | 電池工作一段時(shí)間后,乙池的c(SO42- )減小 | |
| C. | 電子從鋅極經(jīng)過(guò)導(dǎo)線移向銅極 | |
| D. | 電池工作一段時(shí)間后,甲池的c(Zn2+ )增加 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
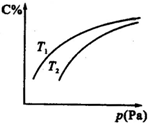
| A. | B一定為氣體 | |
| B. | A一定為氣體 | |
| C. | 若正反應(yīng)方向△H<0,則T1>T2 | |
| D. | 壓強(qiáng)增大時(shí),混合氣體的平均相對(duì)分子質(zhì)量減小 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
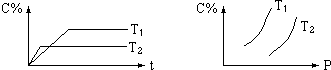
| A. | T1<T2 | B. | m+n<e | ||
| C. | 正反應(yīng)是吸熱反應(yīng) | D. | 逆反應(yīng)是放熱反應(yīng) |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | ①④⑤⑧ | B. | ②④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com