
【題目】設NA為阿伏加德羅常數的值。下列說法正確的是
A.常溫下,1 mol濃硝酸與足量Al反應,轉移電子數為3NA
B.標準狀況下,5.6 L Cl2完全溶解于水配成1 L溶液,溶液中Cl-數為0.5NA
C.20 gH218O含有的中子數為10NA
D.1 L 0.5 mol·L-1 Al2(SO4)3溶液中陽離子所帶電荷數為3NA
科目:高中化學 來源: 題型:
【題目】“封管實驗”具有簡易、方便、節約、綠色等優點,下列關于三個“封管實驗”(夾持裝置未畫出)的說法正確的是( )

A. 加熱時,①中上部匯集了NH4Cl固體
B. 加熱時,②中溶液變紅,冷卻后又都變為無色
C. 加熱時,③中溶液紅色褪去,冷卻后溶液變紅,體現SO2的漂白性
D. 三個“封管實驗”中所發生的化學反應都是可逆反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期的五種元素A、B、C、D、E,原子序數依次增大。A、B、C三種元素電子層數之和是5。A、B兩元素原子最外層電子數之和等于C元素原子最外層電子數;B元素原子最外電子層上的電子數是它的電子層數的2倍,A與D可以形成原子個數比分別為1∶1和2∶1的兩種液態化合物;E單質用于凈化水質。
請回答:
(1)寫出D在元素周期表中的位置_____________________,
E的原子結構示意圖是________。
下列可以驗證C與D兩元素原子得電子能力強弱的實驗事實是____(填寫編號)。
A.比較這兩種元素的氣態氫化物的沸點
B.比較只有這兩種元素所形成的化合物中的化合價
C.比較這兩種元素的氣態氫化物的穩定性
D.比較這兩種元素的單質與氫氣化合的難易
(2)由A、B兩種元素組成的最簡單的化合物,寫出其電子式____。
(3)均由A、B、C、D四種元素組成的甲、乙兩種化合物,都既可以與鹽酸反應又可以與NaOH溶液反應,甲為無機鹽,其化學式為____,乙為天然高分子化合物的水解產物,且是同類物質中相對分子質量最小的,其結構簡式為___________。
(4)膠態磁流體在醫學上有重要的用途,而納米級Fe3O4是磁流體中的重要粒子,其制備過程可簡單表示如下:
①將化合物CA3通入等物質的量的FeSO4、Fe2(SO4)3的混合溶液中,生成兩種堿,寫出該反應過程的總的離子方程式___________________________________。
②上述反應生成的兩種堿繼續作用,得到Fe3O4。
(5)已知下表數據:
物質 | Fe(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的濃度均為2.0 mol·L-1,則混合液中c(OH-)不得大于____mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組探究醋酸的溶液情況,進行了如下實驗。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液時需要用到的玻璃儀器有量筒、燒杯、玻璃棒、___________和___________。
(2)該學習小組用pH試紙對上述0.5000 mol·L-1醋酸溶液進行了pH測定,請用文字描述pH試紙的使用方法______。
(3)用上述0.5000 mol·L-1的醋酸溶液再進行稀釋,為測定稀釋后醋酸溶液的準確濃度,用0.2000 mol·L-1的NaOH溶液對25.00 mL醋酸溶液進行滴定,幾次滴定消耗NaOH溶液的體積如下:
實驗序號 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的體積(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
則該醋酸溶液的濃度為________________。
(4)實驗(2)中,滴定過程中pH變化曲線如圖所示(室溫條件下)。

①滴定過程中,當滴加12.50mLNaOH時,所得混合溶液中離子濃度由大到小順序為____________。
②當滴加25.00mLNaOH時,反應后測得混合溶液的pH=9。則混合溶液中:水的電離度是純水的_____倍;
(5)在滴定過程中,下列操作會造成結果偏高的是________。
A.滴定終點時,滴定管尖嘴處有半滴懸而未落
B.讀取NaOH溶液體積時,開始仰視讀數,滴定結束后俯視讀數
C.滴定過程中向錐形瓶中加水
D.滴定管水洗后未用標準液潤洗
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲線如圖。下列說法不正確的是( )

A. 在曲線上任一點均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 點①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 點②所示溶液中:c(Na+) = c(CH3COO-)
D. 點③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 時,向
時,向![]() 中不斷滴入
中不斷滴入![]() ,混合溶液pH變化如圖所示。此過程溶液下列說法不正確的是
,混合溶液pH變化如圖所示。此過程溶液下列說法不正確的是![]() 已知:
已知:![]() 時一元酸
時一元酸![]() 電離平衡常數
電離平衡常數![]()
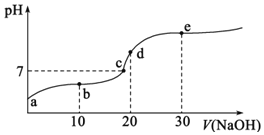
A.a點溶液的pH大于3
B.b點溶液中離子:![]()
C.c點表示酸![]() 和
和![]() 溶液恰好完全反應
溶液恰好完全反應
D.d點溶液加水稀釋后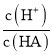 的值會增大
的值會增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F六種物質的相互轉化關系如 下圖所示(反應條件未標出),其中反應①是置換反應。
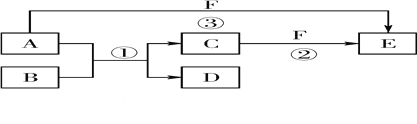
(1)若A是常見的金屬單質,D、F是氣態單質,反應① 在水溶液中進行,則反應②(在水溶液中進行)的離子方程式是__________。
(2)若B、C、F都是氣態單質,且B有毒,③的反應中還有水生成,反應②需要放電才能發生,A、D相遇有白煙生成,則A、D反應產物的電子式是________,反應③的化學方程式是____。
(3)若A、D、F都是短周期元素組成的非金屬單質,且A、D所含元素同主族,A、F所含元素同周期,則反應①的化學方程式是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)一定溫度下,在容積固定的密閉容器中進行的可逆反應:2NO2![]() 2NO+O2,達到平衡的標志是
2NO+O2,達到平衡的標志是
①相同時間內,氧氣的生成速率為n mol·L-1·s-1,NO2的生成速率為2n mol·L-1·s-1
②單位時間內生成n mol O2的同時生成2n mol的NO
③混合氣體的顏色不再變化 ④混合氣體的密度保持不變
⑤混合氣體的平均相對分子質量不再改變 ⑥壓強不隨時間變化而變化
A. ①③⑤⑥ B. ②③⑤
C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鍺(Ge)是典型的半導體元素,在電子、材料等領域應用廣泛。回答下列問題:
(1)基態Ge原子的核外電子排布式為[Ar]________,有________個未成對電子。
(2)光催化還原CO2制備CH4反應中,帶狀納米Zn2GeO4是該反應的良好催化劑。Zn、Ge、O電負性由大至小的順序是________________。
(3)Ge單晶具有金剛石型結構,其中Ge原子的雜化方式為________________________,微粒之間存在的作用力是________________。
(4)晶胞有兩個基本要素:
①原子坐標參數,表示晶胞內部各原子的相對位置。下圖為Ge單晶的晶胞,其中原子坐標參數A為(0,0,0);B為(![]() ,0,
,0,![]() );C為(
);C為(![]() ,
,![]() ,0)。則D原子的坐標參數為________。
,0)。則D原子的坐標參數為________。
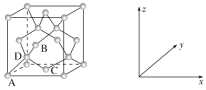
②晶胞參數,描述晶胞的大小和形狀,已知Ge單晶的晶胞參數a=565.76 pm,其密度為________g·cm-3(列出計算式即可)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com