
在酸性條件下,次氯酸鈉、過氧化氫都有很強的氧化性,可將Fe2+氧化為Fe3+.Mg(OH)2和Fe(OH)2在溶液中生成時呈膠狀物或絮狀物沉淀,而MgCO3在水中煮沸可轉變為Mg(OH)2.“鹵塊”的主要成分為MgCl2(含有FeCl2、FeCl3、MnCl2等雜質).若以它為原料,按下圖工藝流程可制得“輕質氧化鎂”.要求產品不含雜質離子,而且成本較低,流程中溶液pH調節和所用試劑可參考表1、表2來確定.


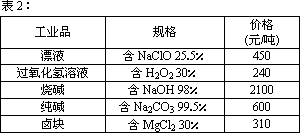
請填下列空白:
(1)在步驟②中加入物質X,最佳的選擇應是________,理由是________;步驟②中反應的離子方程式為________.
(2)在步驟③中要控制pH=9.8,其目的是________.
(3)在步驟④中加入物質應是________.
(4)在步驟⑤中發生的化學方程式為________.
科目:高中化學 來源: 題型:閱讀理解
| 信息卡 常溫下碳酸鈣難溶于水,氫氧化鈣微溶于水,氯化鈣易溶于水.次氯酸鈣易溶于水,酸性條件下不穩定、100°C時發生分解反應. 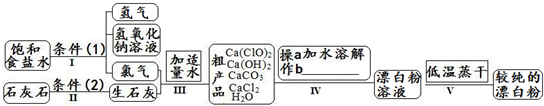 (1)流程I 得到濃度為80g?L-1氫氧化鈉溶液,其物質的量濃度是 2 2 mol?L-1.(2)寫出流程I發生反應的化學反應方程式,并用雙線橋表示其電子轉移的方向和數目:   高溫 高溫 .(3)流程III中發生兩個反應,寫出其中的氧化還原反應的化學反應方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化劑是Cl2 Cl2 ;還原劑是Cl2 Cl2 .(寫化學式)(4)流程IV中操作b是: 過濾 過濾 .(寫名稱)(5)流程V進行低溫蒸干的原因是: Ca(ClO)2在100°C時發生分解反應 Ca(ClO)2在100°C時發生分解反應 .(6)用化學方程式說明較純的次氯酸鈣粉末必須密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸鈣都能起漂白、消毒作用.是因為它們都能產生同一種物質,寫出氯氣與水反應產生該物質的化學方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性條件下次氯酸鈣的氧化性比氯氣強,能將溴離子氧化成溴單質,而次氯酸鈣中的氯元素則被還原為負一價的氯離子,氧元素則轉化為水.試寫出次氯酸鈣和稀鹽酸的混合物與溴化鈉反應的化學方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
查看答案和解析>> 科目:高中化學 來源: 題型:閱讀理解 【化學--選修2:化學與技術】自來水生產的流程示意圖見下:  (1)混凝劑除去懸浮物質的過程 ③ ③ (填寫序號)①只是物理變化 ②只是化學變化 ③是物理和化學變化 FeSO4?7H2O是常用的混凝劑,它在水中最終生成 Fe(OH)3 Fe(OH)3 沉淀.(2)若要除去Ca2+、Mg2+可以往水中加入石灰和純堿,試劑填加時先加 石灰 石灰 后加純堿 純堿 ,原因是過量的鈣離子可通過純堿使之沉淀下來 過量的鈣離子可通過純堿使之沉淀下來 .(3)氯氣消毒,是因為它與水反應生成了HClO,次氯酸的強氧化性能殺死水中的病菌(不能直接用次氯酸為自來水消毒是因為次氯酸易分解,且毒性較大). Cl2+H2O?HCl+HClO K=4.5×10-4 使用氯氣為自來水消毒可以有效地控制次氯酸的濃度,請結合平衡常數解釋原因: 由氯氣與水反應的平衡常數可知,該反應的限度很小,生成的HClO濃度很小,且隨著HClO的消耗,平衡會不斷向正反應移動,補充HClO 由氯氣與水反應的平衡常數可知,該反應的限度很小,生成的HClO濃度很小,且隨著HClO的消耗,平衡會不斷向正反應移動,補充HClO .下列物質中,①③ ①③ 可以作為氯氣的代用品(填寫序號).①臭氧 ②NH3(液) ③K2FeO4 ④SO2 (4)有些地區的天然水中含有較多的鈣、鎂離子.用離子交換樹脂軟化硬水時,先后把水通過分別裝有 陽 陽 離子交換樹脂和陰 陰 離子交換樹脂的離子交換柱(填“陰”或“陽”,陽離子交換樹脂為HR型,陰離子交換樹脂為R′OH型).(5)測定水中的溶解氧:量取40mL水樣,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振蕩使完全反應.打開塞子,迅速加入適量硫酸溶液,此時有碘單質生成.用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液.已知在堿性溶液中,氧氣能迅速氧化Mn2+,生成物在酸性條件下可以將碘離子氧化為碘單質,本身重新還原為Mn2+.上述過程發生的反應可表示為:2Mn2++4OH-+O2=2MnO(OH)2 MnO(OH)2+2I-+4H+=I2+Mn2++3H2O I2+2S2O32-=2I-+S4O62- 則水中的溶解氧量為 12.0 12.0 mg?L-1.查看答案和解析>> 科目:高中化學 來源: 題型: (10分)碘酸鉀是一種白色結晶粉末,無臭無味。在酸性條件下碘酸鉀是一種較強的氧化劑,與氫碘酸、二氧化硫等還原性物質作用,被還原為單質碘,在堿性介質中,碘酸鉀能被氯氣、次氯酸鹽等氧化為高碘酸鉀。碘酸鉀在常溫下穩定,加熱至560 ℃開始分解。工業生產碘酸鉀的流程如下圖所示。 (1)在反應器中發生的反應I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成兩種還原產物所得電子數目相同,請寫出已配平的該反應的化學方程式: 。 (2)步驟②中,用硝酸而不用HI,其原因可能是 。 (3)步驟③要保持溶液微沸1小時以完全排出氯氣,排出氯氣的原因為 。 (4)參照下表碘酸鉀的溶解度,步驟⑾得到碘酸鉀晶體,應采用的方法是 。
(5)KIO3可用電解的方法制得,原理是以石墨為陽極,以不銹鋼為陰極,在一定溫度和電流下電解KI溶液。總反應方程式為KI+3H2O=KIO3+3H2↑,則陰極的電極反應式為 。
查看答案和解析>> 科目:高中化學 來源:2012屆北京市順義區高三尖子生綜合素質展示化學試卷 題型:實驗題 (10分)碘酸鉀是一種白色結晶粉末,無臭無味。在酸性條件下碘酸鉀是一種較強的氧化劑,與氫碘酸、二氧化硫等還原性物質作用,被還原為單質碘,在堿性介質中,碘酸鉀能被氯氣、次氯酸鹽等氧化為高碘酸鉀。碘酸鉀在常溫下穩定,加熱至560 ℃開始分解。工業生產碘酸鉀的流程如下圖所示。
查看答案和解析>> 科目:高中化學 來源:2010-2011學年廣東省高三臨門一腳綜合測試(理綜)化學部分 題型:填空題 KIO3在酸性條件下是一種較強的氧化劑,在堿性介質中能被Cl2、次氯酸鹽氧化為KIO4。KIO3在常溫下穩定,加熱至560℃開始分解。工業生產KIO3的流程如下:
(1)寫出反應器中生成KH(IO3)2的化學方程式: 6I2+11KClO3+3H2O= 。 當有1.2 mol電子轉移的時候,生成KH(IO3)2的物質的量為 。 (2)生產過程中,在反應器中加入反應物之后,還需加入硝酸酸化并保持微沸1小時,加硝酸的目的是 。微沸1小時的目的是 。 (3)調pH=10時,所加試劑C最好是 。 A.NaOH B.NH3·H2O C.KOH D.KCI (4)從溶液B中得到碘酸鉀固體,進行的操作I包括 。 A.蒸發濃縮 B.冷卻結晶 C.蒸發結晶 D.過濾洗滌
查看答案和解析>> 同步練習冊答案 湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區 違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com版權聲明:本站所有文章,圖片來源于網絡,著作權及版權歸原作者所有,轉載無意侵犯版權,如有侵權,請作者速來函告知,我們將盡快處理,聯系qq:3310059649。 ICP備案序號: 滬ICP備07509807號-10 鄂公網安備42018502000812號 |