
| A. | 20 | B. | 21 | C. | 22 | D. | 23 |
分析 二氧化硫與氨水完全反應生成鹽,可能為NH4HSO3或(NH4)2SO3,向所得溶液中加入0.7mol Na2O2固體,過氧化鈉能氧化NH4HSO3或(NH4)2SO3,生成硫酸根離子,充分反應后加熱使氣體全部逸出,氣體為氨氣、氧氣,以此計算.
解答 解:二氧化硫與氨水完全反應生成鹽,可能為NH4HSO3或(NH4)2SO3,由N原子守恒可知,物質的量分別為0.1L×5mol/L=0.5mol、0.1L×5mol/L×$\frac{1}{2}$=0.25mol,
向所得溶液中加入0.7mol Na2O2固體,
①若鹽為NH4HSO3,發生Na2O2+NH4++HSO3-$\frac{\underline{\;\;△\;\;}}{\;}$2Na++SO42-+NH3↑+H2O,發生氧化還原反應消耗過氧化鈉為$\frac{0.5mol×(6-4)}{2×(2-1)}$=0.5mol,同時生成氨氣為0.5mol,由2Na2O2+2H2O=4NaOH+O2↑可知,生成氧氣為(0.7mol-0.5mol)×$\frac{1}{2}$=0.1mol,則氣體的平均相對分子質量為$\frac{0.5×17+0.1×32}{0.5+0.1}$=19.5;
②若鹽為(NH4)2SO3,發生Na2O2+2NH4++SO32-$\frac{\underline{\;\;△\;\;}}{\;}$2Na++SO42-+2NH3↑+H2O,發生氧化還原反應消耗過氧化鈉為$\frac{0.25mol×(6-4)}{2×(2-1)}$=0.25mol,銨根離子完全反應,生成氨氣為0.5mol,由2Na2O2+2H2O=4NaOH+O2↑可知,生成氧氣為(0.7mol-0.25mol)×$\frac{1}{2}$=0.225mol,則氣體的平均相對分子質量為$\frac{0.5×17+0.225×32}{0.5+0.225}$=21.66,
③若鹽為NH4HSO3、(NH4)2SO3的混合物,則生成氣體的平均相對分子質量為19.5<M<21.66,
故選AB.
點評 本題考查氧化還原反應的計算,為高頻考點,涉及電子守恒、平均相對分子質量的計算等,側重分析與計算能力的考查,注意極值法在計算中的應用,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 25℃時,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)隨溫度和濃度的變化而變化 | |
| C. | 該體系中沒有沉淀產生 | |
| D. | 該體系中有CaF2產生沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素編號 | 元素性質或結構 |
| X | 3p亞層上有1個空軌道 |
| Y | 第三周期元素形成的簡單離子中半徑最大 |
| Z | 短周期中原子最容易失電子 |
| A. | 氫化物的穩定性:X<Y | B. | 單質與水反應的難易程度:Y>Z | ||
| C. | 單質的熔點:X<Y<Z | D. | X、Y、Z的氧化物晶體類型相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2SO4溶液中:c(H+)═c(SO42-)+c(HSO4-)+c(OH-) | |
| B. | 氨水中:c(NH4+)═c(OH-)>c(H+) | |
| C. | a mol•L-1的醋酸與0.01 mol•L-1的氫氧化鈉溶液等體積混合后呈中性,則醋酸的Ka=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 0.1 mol•L-1的鹽酸與0.2 mol•L-1氨水等體積混合后,溶液中:c(OH-)+c(Cl-)═c(H+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
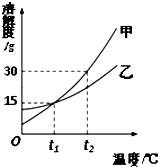 甲、乙兩種固體的溶解度曲線如圖所示,下列說法正確的是( )
甲、乙兩種固體的溶解度曲線如圖所示,下列說法正確的是( )| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 將甲的飽和溶液變為不飽和溶液可采用降溫的方法 | |
| C. | t1℃時,甲、乙的飽和溶液中溶質的質量分數不一定相等 | |
| D. | t2℃時,將甲、乙等質量的飽和溶液降溫至t1℃,甲析出的固體一定大于乙 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 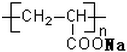 表示一種吸水性高分子樹脂 表示一種吸水性高分子樹脂 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白質均可以發生水解反應 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 異丁烷的八氯代物共有4種(不考慮立體異構) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 表1.幾種砷酸鹽的Ksp | |
| 難溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-9 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 7.2×10-21 |
| 表2.工廠污染物排放濃度及允許排放標準 | ||
| 污染物 | H2SO4 | As |
| 濃度 | 19.6g/L | 1.6g•L-1 |
| 排放標準 | pH6~9 | 0.5mg•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com