

| A.反應進行的前3 min內,用X表示的反應速率v(X)=0.3 mol·(L·min)-1 |
B.容器中發(fā)生的反應可表示為3X(g)+Y(g)  2Z(g) 2Z(g) |
| C.保持其他條件不變,升高溫度,反應的化學平衡常數(shù)K減小 |
| D.若改變反應條件,使反應進程如圖3所示,則改變的條件是增大壓強 |
科目:高中化學 來源:不詳 題型:單選題
 2HF(g) ΔH>0,且平衡體系的總質量(m總)與總物質的量(n總)之比在不同溫度下隨壓強的變化曲線如圖所示。下列說法正確的是
2HF(g) ΔH>0,且平衡體系的總質量(m總)與總物質的量(n總)之比在不同溫度下隨壓強的變化曲線如圖所示。下列說法正確的是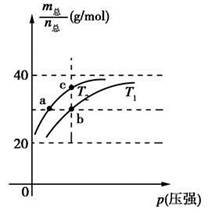
| A.溫度:T1<T2 |
| B.平衡常數(shù):K(a)=K(b)<K(c) |
| C.反應速率:vb>va |
D.當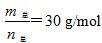 時,n(HF):n[(HF)2]=2:1 時,n(HF):n[(HF)2]=2:1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 p C中,m、n、p為各物質的計量數(shù)。現(xiàn)測得C每分鐘增加a mol/L,B每分鐘減少1.5a mol/L,A每分鐘減少0.5a mol/L,則m:n:p為
p C中,m、n、p為各物質的計量數(shù)。現(xiàn)測得C每分鐘增加a mol/L,B每分鐘減少1.5a mol/L,A每分鐘減少0.5a mol/L,則m:n:p為| A.2:3:1 | B.1:3:2 | C.2:3:3 | D.3:2:1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CO2(g)+H2(g);反應過程中測定的部分數(shù)據(jù)見下表(表中t2>t1),下列說法正確的是
CO2(g)+H2(g);反應過程中測定的部分數(shù)據(jù)見下表(表中t2>t1),下列說法正確的是| 反應時間/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
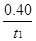 mol·L-1·min-1
mol·L-1·min-1查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.1.5mol/(L·min) | B.0.15mol/(L·min) |
| C.0.75mol/(L·min) | D.0.075mol/(L·min) |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2NO2(g)體系中,n(NO)隨時間變化如下表:
2NO2(g)體系中,n(NO)隨時間變化如下表:| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2B(g) ΔH=-a kJ·mol-1。其中B的物質的量濃度隨時間變化如圖所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物質的量濃度隨時間變化如圖所示。
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com