
【題目】(1)![]() 可用作食鹽的抗結劑,高溫下
可用作食鹽的抗結劑,高溫下![]() 會分解生成
會分解生成![]() 、KCN、
、KCN、![]() 、
、![]() C、C等物質,上述物質中涉及的幾種元素的第一電離能由大到小的順序為______;
C、C等物質,上述物質中涉及的幾種元素的第一電離能由大到小的順序為______;![]() 中,鐵原子不是采用
中,鐵原子不是采用![]() 雜化的理由是______。
雜化的理由是______。
(2)![]() 氣態為單分子時,分子中S原子的雜化軌道類型為______,分子的立體構型為______;
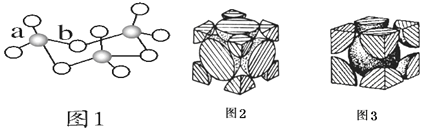
氣態為單分子時,分子中S原子的雜化軌道類型為______,分子的立體構型為______;![]() 的三聚體環狀結構如圖1所示,該結構中
的三聚體環狀結構如圖1所示,該結構中![]() 鍵長有a、b兩類,b的鍵長大于a的鍵長的可能原因為______。
鍵長有a、b兩類,b的鍵長大于a的鍵長的可能原因為______。
(3)已知:多原子分子中,若原子都在同一平面上且這些原子有相互平行的p軌道,則p電子可在多個原子間運動,形成“離域![]() 鍵”
鍵”![]() 或大
或大![]() 鍵
鍵![]() 。大
。大![]() 鍵可用
鍵可用![]() 表示,其中m、n分別代表參與形成大
表示,其中m、n分別代表參與形成大![]() 鍵的電子數和原子個數,如苯分子中大
鍵的電子數和原子個數,如苯分子中大![]() 鍵表示為
鍵表示為![]() 。
。
①下列微粒中存在“離域![]() 鍵”的是______;
鍵”的是______;
A.![]()
![]()
![]()
![]()
②![]() 分子中大
分子中大![]() 鍵可以表示為______;
鍵可以表示為______;
(4)鐵、鉀兩種單質的堆積方式剖面圖分別如圖2、圖3所示。鐵晶體中原子的空間利用率為______![]() 用含
用含![]() 的式子表示
的式子表示![]() 。
。
【答案】![]()
![]() 中
中![]() 配位數為6
配位數為6 ![]() V形 形成b鍵的氧原子與兩個S原子結合,原子之間形成單鍵,作用力較小
V形 形成b鍵的氧原子與兩個S原子結合,原子之間形成單鍵,作用力較小 ![]()
![]()
![]()
【解析】
(1)第一電離能實際上就是失電子的難易程度,電離能越小則代表失電子越容易,則還原性越強,因此可以從氧化還原性的強弱來考慮;
(2)鍵長與鍵能呈負相關,即鍵越長則能量越低,越容易斷裂;對于穩定性而言是三鍵>雙鍵>單鍵,則鍵長是單鍵>雙鍵>三鍵;
(3)題干中已經告知我們大![]() 鍵的形成條件,因此我們只要從這些微粒的分子結構來判斷存不存在相互平行的p軌道即可;
鍵的形成條件,因此我們只要從這些微粒的分子結構來判斷存不存在相互平行的p軌道即可;
(4)利用率即“原子的體積占整個晶胞體積的百分比”,分別算出二者的體積再構造分式即可。
![]() 一般金屬性越強則第一電離能越小,同周期主族元素隨原子序數增大第一電離能呈增大趨勢,IIA族、VA族為全充滿或半充滿穩定狀態,第一電離能高于同周期相鄰元素的,故第一電離能:
一般金屬性越強則第一電離能越小,同周期主族元素隨原子序數增大第一電離能呈增大趨勢,IIA族、VA族為全充滿或半充滿穩定狀態,第一電離能高于同周期相鄰元素的,故第一電離能:![]() ;
;![]() 與
與![]() 形成6個配位鍵,
形成6個配位鍵,![]() 配位數為6,
配位數為6,![]() 雜化無法形成6個空軌道;
雜化無法形成6個空軌道;
![]() 分子中S原子形成2個
分子中S原子形成2個![]() 鍵,孤電子對數為
鍵,孤電子對數為![]() ,價層電子對數
,價層電子對數![]() ,故分子中S原子的雜化軌道類型為
,故分子中S原子的雜化軌道類型為![]() 雜化,分子的立體構型為V形;連接2個S原子的氧原子與S原子之間形成單鍵,連接1個S原子的氧原子與S之間形成雙鍵,單鍵之間作用力比雙鍵弱,單鍵的鍵長較長;
雜化,分子的立體構型為V形;連接2個S原子的氧原子與S原子之間形成單鍵,連接1個S原子的氧原子與S之間形成雙鍵,單鍵之間作用力比雙鍵弱,單鍵的鍵長較長;
![]() 形成離域
形成離域![]() 鍵的條件是“原子都在同一平面上且這些原子有相互平行的p軌道“,硫酸根離子是正四面體結構,原子不處于同一平面內,硫化氫中H原子和S原子沒有平行的p軌道,
鍵的條件是“原子都在同一平面上且這些原子有相互平行的p軌道“,硫酸根離子是正四面體結構,原子不處于同一平面內,硫化氫中H原子和S原子沒有平行的p軌道,![]() 為V形結構,
為V形結構,![]() 為平面三角形,有相互平行的p軌道,可以形成離域
為平面三角形,有相互平行的p軌道,可以形成離域![]() 鍵,
鍵,
故答案為AD;
![]() 為直形型結構,有相互平行的p軌道,
為直形型結構,有相互平行的p軌道,![]() 分子中大
分子中大![]() 鍵可以表示為:
鍵可以表示為:![]() ;
;
![]() 鐵的晶體為面心立方最密堆積,令Fe原子的半徑為rcm,則晶胞的棱長為
鐵的晶體為面心立方最密堆積,令Fe原子的半徑為rcm,則晶胞的棱長為![]() ,晶胞體積
,晶胞體積![]()
![]() ,晶胞中Fe原子數目
,晶胞中Fe原子數目![]() ,晶胞中Fe原子總體積
,晶胞中Fe原子總體積![]() ,晶胞中原子的空間利用率
,晶胞中原子的空間利用率![]()
![]() 。
。


 桃李文化快樂暑假武漢出版社系列答案
桃李文化快樂暑假武漢出版社系列答案 優秀生快樂假期每一天全新寒假作業本系列答案
優秀生快樂假期每一天全新寒假作業本系列答案 暑假接力賽新疆青少年出版社系列答案
暑假接力賽新疆青少年出版社系列答案科目:高中化學 來源: 題型:
【題目】合成氨工藝的一個重要工序是銅洗,其目的是用銅液![]() 醋酸二氨合銅
醋酸二氨合銅![]() Ⅰ
Ⅰ![]() ,氨水
,氨水![]() 吸收在生產過程中產生的CO和
吸收在生產過程中產生的CO和![]() 等氣體,銅液吸收CO的反應是放熱反應,其反應方程式為:
等氣體,銅液吸收CO的反應是放熱反應,其反應方程式為:![]() ; 完成下列填空:
; 完成下列填空:
![]() 如果要提高上述反應的反應速率,可以采取的措施是 ______
如果要提高上述反應的反應速率,可以采取的措施是 ______ ![]() 選填編號
選填編號![]()
![]() 減壓
減壓 ![]() 增加
增加![]() 的濃度
的濃度 ![]() 升溫
升溫 ![]() 及時移走產物
及時移走產物
![]() 銅液中的氨可吸收二氧化碳,寫出該反應的化學方程式: ______
銅液中的氨可吸收二氧化碳,寫出該反應的化學方程式: ______
![]() 簡述銅液吸收CO及銅液再生的操作步驟
簡述銅液吸收CO及銅液再生的操作步驟![]() 注明吸收和再生的條件
注明吸收和再生的條件![]() .______
.______
![]() 銅液的組成元素中,短周期元素原子半徑從大到小的排列順序為 ______ 通過比較 ______ 可判斷氮、磷兩種元素的非金屬性強弱.
銅液的組成元素中,短周期元素原子半徑從大到小的排列順序為 ______ 通過比較 ______ 可判斷氮、磷兩種元素的非金屬性強弱.
![]() 已知
已知![]() 與
與![]() 分子結構相似,
分子結構相似,![]() 的電子式是 ______
的電子式是 ______ ![]() 熔點高于
熔點高于![]() ,其原因是 ______
,其原因是 ______
![]() 提取的
提取的![]() 中含少量
中含少量![]() 、
、![]() 將產品溶解,加入
將產品溶解,加入![]() ,加熱至沸,再加入
,加熱至沸,再加入![]() 溶液,過濾,蒸發結晶,得到工業氯化銨.加熱至沸的目的是 ______
溶液,過濾,蒸發結晶,得到工業氯化銨.加熱至沸的目的是 ______ ![]() 濾渣的主要成分是 ______ 、 ______ .
濾渣的主要成分是 ______ 、 ______ .
![]() 稱取
稱取![]() 小蘇打樣品
小蘇打樣品![]() 含少量
含少量![]() ,配置成250mL溶液,取
,配置成250mL溶液,取![]() 用
用![]() 鹽酸滴定,消耗鹽酸
鹽酸滴定,消耗鹽酸![]() 實驗中所需的定量儀器出滴定管外,還有 ______
實驗中所需的定量儀器出滴定管外,還有 ______ ![]() 選甲基橙而不選酚酞作為指示劑的原因是 ______
選甲基橙而不選酚酞作為指示劑的原因是 ______ ![]() 樣品中
樣品中![]() 質量分數為 ______
質量分數為 ______ ![]() 保留3位小數
保留3位小數![]()
![]() 將一定量小蘇打樣品
將一定量小蘇打樣品![]() 含少量
含少量![]() 溶于足量鹽酸,蒸干后稱量固體質量,也可測量定小蘇打的含量.若蒸發過程中有少量液體濺出,則測定結果 ______
溶于足量鹽酸,蒸干后稱量固體質量,也可測量定小蘇打的含量.若蒸發過程中有少量液體濺出,則測定結果 ______ ![]() 選填“偏高”、“偏低”或“不受影響”
選填“偏高”、“偏低”或“不受影響”![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖的實驗裝置可用于研究SO2轉化為SO3的轉化率。已知:SO3的熔點是16.8℃,沸點是44.8℃。A處為SO2氣體發生裝置,C處為SO2與O2反應的裝置。
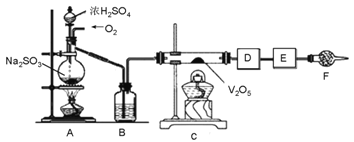
完成下列填空:
(1).A處的化學反應方程式為__________________,儀器F的名稱為___________________________。
(2).根據實驗需要,應該在D、E處連接合適的裝置。請從下圖中選擇,將所選裝置的序號填入相應的空格,D:________________,E:______________。

(3).用amolNa2SO3粉末與足量濃硫酸進行此實驗,當A處反應結束時,再繼續通入一段時間O2,最后測得E處裝置增重bg,則此時SO2的轉化率為_____%(用含a、b的代數式表示)。
(4).若Na2SO3變質,會影響到SO2的轉化。現欲檢驗某Na2SO3樣品是否變質,你的方法是____________________________________________________________________________________________。
(5).實驗結束后,如果將收集了SO3的裝置敞口露置于空氣中,可看到裝置出口處產生大量白霧,其原因是___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以NA表示阿伏加德羅常數,下列說法中正確的是( )
A. 53g碳酸鈉中含NA個CO32—B. 0.1molOH—含NA電子
C. 1.8g重水(D2O)中含NA個中子D. 標準狀況下11.2L臭氧(O3)中含NA個氧原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下有①6.72L甲烷②3.01×1023個氯化氫分子③13.6 g硫化氫④0.2 mol NH3。下列對這四種氣體的關系從小到大表示不正確的是
A.體積:④<①<②<③B.密度:①<④<③<②
C.質量:④<①<③<②D.氫原子數:②<④<③<①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是:
A.氫氣燃燒熱為285.5kJ·mol-1,則2H2O(l)=2H2(g)+O2(g) △H=+285.5 kJ·mol-1
B.等pH的強堿與弱堿,稀釋相同的倍數,弱堿pH值偏小
C.中和熱的實驗過程中,環形玻璃攪拌棒如果用銅代替,則測量出的中和熱數值偏小
D.已知N2(g)+3H2(g)![]() 2 NH3(g) ;△H=-92.4kJ·mol-1,則在一定條件下將1molN2和4molH2置于一密閉容器中充分反應后,最多可放出92.4kJ的熱量
2 NH3(g) ;△H=-92.4kJ·mol-1,則在一定條件下將1molN2和4molH2置于一密閉容器中充分反應后,最多可放出92.4kJ的熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據圖中氮元素及其化合物的轉化關系,回答問題:
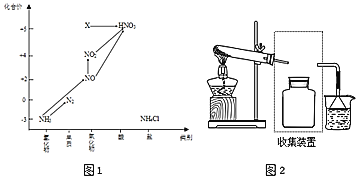
(1)圖1中,X的化學式為_____,從化合價上看,X具有______性(“氧化”、“還原”)。
(2)回答下列關于NH3的問題:
①實驗室常用NH4Cl與Ca(OH)2制取氨氣,該反應的化學方程式為__________。
②下列試劑不能用于干燥NH3的是__________(填字母)。
A.濃硫酸 B.堿石灰 C.生石灰
③若要收集一瓶氨氣,采用的方法是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1)![]() (指出所含官能團名稱)_____________________
(指出所含官能團名稱)_____________________
(2)相對分子質量為72且沸點最低的烷烴的習慣名稱是________________________________
(3) 寫出3,3—二甲基丁酸的結構簡式______________________________
(4)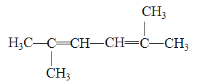 的系統命名為________________________;
的系統命名為________________________;
(5)合成高聚物![]() 其單體的鍵線式___________________________________
其單體的鍵線式___________________________________
(6)甲苯可用于制造烈性炸藥TNT,該反應的化學方程式為__________________________________________
(7)某烴的結構式用鍵線式可表示為![]() ,若該烴與Br2發生加成反應(反應物的物質的量之比為1∶1),則所得產物(不考慮順反異構)有__________種。
,若該烴與Br2發生加成反應(反應物的物質的量之比為1∶1),則所得產物(不考慮順反異構)有__________種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通過對煤的綜合利用,可以獲得多種有機物。化合物A含有碳、氫、氧3種元素,其質量比是12:3:8。液態烴B是一種重要的化工原料,其摩爾質量為78 gmol-1。E是有芳香氣味的酯。它們之間的轉化關系如下(含有相同官能團的有機物通常具有相似的化學性質):
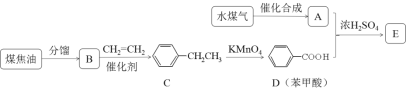
請回答:
(1)化合物A所含的官能團名稱是_____________。
(2)B和CH2=CH2反應生成C的反應類型是_____________。
(3)E在氫氧化鈉溶液中水解的化學方程式是_____________。
(4)下列說法正確的是_____________。
A.將銅絲在空氣中灼燒后迅速插入A中,反應多次,可得到能發生銀鏡反應的物質
B.在一定條件下,C可通過取代反應轉化為![]()
C.苯甲酸鈉(常用作防腐劑)可通過D和氫氧化鈉反應得到
D.共a mol的B 和D混合物在氧氣中完全燃燒,消耗氧氣大于7.5a mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com