
| A. | 電解過程中,Na+和SO42-的物質的量濃度保持不變 | |
| B. | 電解過程中,溶液顏色呈現紅色→紫色→藍色的變化 | |
| C. | 陰極產生的氣體自始至終只有H2 | |
| D. | 第一階段中陰、陽兩極產生的氣體混合引燃后,恰好完全反應得到HCl |
分析 根據電解原理:陰極的放電離子:氫離子,陽極離子的放電順序:氯離子>氫氧根離子,溶液中含有兩種溶質NaCl和H2SO4,根據電解原理和離子物質的量,結合電子守恒計算判斷放電的離子,來判斷電解過程.
解答 解:可以將溶質看成3molNaCl和1molH2SO4,再轉化一下思想,可以看成2molHCl,1molNa2SO4,1molNaCl,
由于1molNa2SO4自始至終無法放電,且其溶液pH=7,暫時可以忽略,電極反應為:
陽極:2Cl--2e-=Cl2↑ 2Cl--2e-=Cl2↑ 4OH--4e-=2H2O+O2↑
2 2 1 1
陰極:2H++2e-=H2↑ 2H++2e-=H2↑ 2H++2e-=H2↑
2 2 1 1
則電解過程可先看成電解HCl,再電解NaCl,最后電解水,
即2HCl$\frac{\underline{\;通電\;}}{\;}$H2↑+Cl2↑,2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑,2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,生成的NaOH為堿性,pH大于7;
A、電解過程中,Na+和SO42-的物質的量不變,但電極過程中溶劑水減少,所以物質的量濃度增大,故A錯誤;
B、陰極電極過程產物分析,開始藍色使石蕊變紅色,隨氫離子放電減小,溶液變為紫色,電解過程中生成的NaOH為堿性,pH大于7石蕊試液顏色又變為藍色,故B正確;
C、陰極上始終是氫離子得到電子生成氫氣,故C正確;
D、第一階段電解的是氯化氫,的及過程中陰、陽兩極產生的氣體氫氣和氯氣,依據電子守恒可知,混合引燃后,恰好完全反應得到HCl,故D正確;
故選A.
點評 本題考查了電解質溶液的混合電解,溶液中離子放電順序,電子守恒是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蓄電池放電時,每消耗0.1molPbO2,則共生成0.1molPbSO4 | |
| B. | 電解硫酸鈉溶液時的陽極反應式為4OH--4e=2H2O+O2↑ | |
| C. | 電解一段時間后若硫酸鈉溶液中沒有晶體析出則c(Na2SO4)不變 | |
| D. | 蓄電池放電一段時間后其電解液中H2SO4的濃度、密度都變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
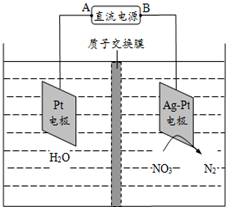
| A. | 鉛蓄電池的A極為正極,電極材料為PbO2 | |
| B. | 該電解池的陰極反應式為:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 該電解池的總反應方程式為:2H2O+4NO3-$\frac{\underline{\;電解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若電解過程中轉移2mol電子,則交換膜右側電解液的質量減少5.6g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 實驗Ⅰ:制備少量氧氣 | |
| B. | 實驗Ⅱ:比較酸性強弱:H2SO4>H2CO3>H2SiO3 | |
| C. | 實驗Ⅲ:分離溴的苯溶液 | |
| D. | 實驗Ⅳ:觀察純堿的焰色反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 干燥的氯氣能使濕潤的有色布條褪色 | |
| B. | 影響氣體體積大小的主要因素是微粒間的距離與微粒的大小 | |
| C. | 湯姆生發現原子中存在電子,并提出了“葡萄干面包式”原子結構模型 | |
| D. | 干冰升華的過程只需克服分子間作用力 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com