
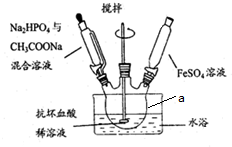
分析 (1)儀器a為三頸燒瓶;
(2)配制溶液時加熱抗壞血酸,防止Fe2+離子被氧化,蒸餾水事先要煮沸除去溶液中的溶解的氧氣;
(2)①分別加入藥品,混合溶液至pH=4時,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;
②制備時需不斷攪拌,使反應物充分接觸,也會防止生成Fe(OH)2沉淀;
(3)生成的Fe3(PO4)2•8H2O 固體混有雜質SO42-離子,通過檢驗SO42-,判斷沉淀洗滌干凈與否;
(4)步驟是分離不溶的固體與液體得到磷酸亞鐵粗產品,需要采取過濾、洗滌等;
(5)用鹽酸溶解,再用KSCN溶液檢驗Fe3+;
(6)根據Fe原子守恒計算Fe3(PO4)2•8H2O的理論產量,進而計算產率.
解答 解:(1)由儀器結構特征,可知儀器a為三頸燒瓶,
故答案為:三頸燒瓶;
(2)Fe2+具有強還原性,配制溶液時加熱抗壞血酸,防止Fe2+離子被氧化,蒸餾水事先要煮沸、冷卻,可以除去溶液中的溶解的氧氣,避免氧化Fe2+;
故答案為:煮沸除去溶液中的溶解的氧氣;
(3)Na2HPO4與CH3COONa混合溶液呈堿性,直接混合容易產生成Fe(OH)2沉淀,實驗時三種溶液分別加入,混合溶液至pH=4時,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;
制備時需不斷攪拌,使反應物充分接觸,也會防止生成Fe(OH)2沉淀;
故答案為:避免生成Fe(OH)2沉淀;使反應物充分接觸,避免生成Fe(OH)2沉淀;
(4)步驟是分離不溶的固體與液體得到磷酸亞鐵粗產品,需要采取過濾、洗滌等,
故答案為:過濾、洗滌;
(5)檢驗磷酸亞鐵粗產品中是否有Fe(OH)3雜質的方法是:取少量固體溶于適量鹽酸,然后滴入KSCN溶液,溶液變紅色,說明含有Fe(OH)3雜質,否則不含,
故答案為:取少量固體溶于適量鹽酸,然后滴入KSCN溶液,溶液變紅色,說明含有Fe(OH)3雜質,否則不含;
(6)15.2gFeSO4的物質的量為$\frac{15.2g}{152g/mol}$=0.1mol,根據Fe元素守恒,理論上得到Fe3(PO4)2•8H2O的質量為0.1mol×$\frac{1}{3}$×502g/mol=16.73g,磷酸亞鐵產率是$\frac{12.8g}{16.73g}$×100%=76.5%,
故答案為:76.5%.
點評 本題考查物質制備實驗方案,涉及對儀器識別、物質的分離提純、對操作的分析評價、實驗方案設計、產率計算等,較好的考查學生信息獲取與知識遷移運用能力,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨水中銨根離子和氫氧化鈉溶液中鈉離子濃度相等 | |
| B. | 溫度下降10℃,兩溶液的pH均不變 | |
| C. | 氨水和氫氧化鈉溶液的濃度相等 | |
| D. | 分別與等濃度的鹽酸反應,氨水消耗鹽酸的體積與氫氧化鈉消耗鹽酸的體積相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HBr、CO2、H2O、CS2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | NaCl、HCl、H2O、NaOH | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com