
分析 (1)根據物質與水的反應物與生成物來書寫化學反應方程式,再利用氧化還原反應中電子轉移計算,然后計算標準狀況下氣體的體積;
(2)根據蓋斯定律來計算化學反應的焓變;根據化學平衡狀態的特征:逆、定、動、變、等來判斷化學反應是否達到平衡;化學平衡狀態時,正逆反應速率相等,各物質的濃度不變,由此衍生的一些物理量也不變,計算平衡時各物質的濃度,可計算平衡常數;
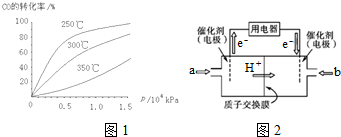
(3)①從橫坐標上一點,畫一條平行于縱坐標的虛線,看相同壓強下不同溫度時CO的平衡轉化率,溫度越低轉化率越低,說明,升溫時平衡向逆向移動;
②根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應,正極上是氧氣得到電子發生還原反應,酸性溶液中生成水.
解答 解:(1)NO2與H2O反應的方程式為:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,當反應中有1 mol NO2參加反應時,共轉移了4 mol電子,故轉移12mol電子時,消耗的NO2為12÷4×22.4L=67.2L,
故答案為:3NO2+H2O═2HNO3+NO;67.2;
(2)根據蓋斯定律,將第二個方程式顛倒過來,與第一個方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ•mol-1,則NO2+SO2?SO3+NO△H=-41.8 kJ•mol-1;
a.本反應是反應前后氣體分子數不變的反應,故體系的壓強保持不變,故a不能說明反應已達到平衡狀態,a錯誤;
b.隨著反應的進行,NO2的濃度減小,顏色變淺,故b可以說明反應已達平衡,故b正確;
c.SO3和NO都是生成物,比例保持1:1,故c不能作為平衡狀態的判斷依據,故c錯誤;
d.d中所述的兩個速率都是逆反應速率,不能作為平衡狀態的判斷依據,故d錯誤.
故選b;
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物質的體積 a 2a 0 0
轉化物質的體積 x x x x
平衡物質的體積 a-x 2a-x x x
平衡時NO2與SO2體積比為1:6,即$\frac{a-x}{2a-x}$=$\frac{1}{6}$,故x=$\frac{4}{5}$a,故平衡常數K=$\frac{c(S{O}_{3})•c(NO)}{c(N{O}_{2})•c(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{(\frac{4}{5}a)^{2}}{\frac{1}{5}a×\frac{6}{5}a}$=$\frac{8}{3}$,
故答案為:-41.8;b;$\frac{8}{3}$;
(3)①從橫坐標上一點0.5處,畫一條平行于縱坐標的虛線,看相同壓強下不同溫度時CO的平衡轉化率,溫度越高轉化率越低,說明,升溫時平衡向逆向移動.
第二問:實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是工業生產要考慮速經濟效益,要考慮速度和效率,壓強越大需要的條件越高,花費越大.
故答案為:<;在1.3×104kPa下,CO的轉化率已較高,再增大壓強CO的轉化率提高不大,而生產成本增加得不償失;
②根據圖知,交換膜是質子交換膜,則電解質溶液呈酸性,根據氫離子移動方向知,通入a的電極為負極、通入b的電極為正極,負極上甲醇失去電子發生氧化反應,負極反應式為 CH3OH-6e-+H2O=CO2+6H+,正極上氧氣得電子發生還原反應,電極反應式為O2+4e-+4H+=2H2O,
故答案為:負;O2+4e-+4H+=2H2O.
點評 本題以NO2、SO2、CO等物質為載體,綜合考查化學方程式的書寫和氧化還原反應,及平衡常數的計算等問題,側重于學生綜合運用化學知識的能力的考查,題目難度中等.


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案科目:高中化學 來源: 題型:解答題
| 電離能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共價鍵 | C-C | C-N | C-S |
| 鍵能/kJ•mol-1 | 347 | 305 | 259 |

| 離子晶體 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲醇被稱為2l世紀的新型燃料,工業上通過下列反應①和②,用CH4和H2O為原料來制備甲醇.
甲醇被稱為2l世紀的新型燃料,工業上通過下列反應①和②,用CH4和H2O為原料來制備甲醇.| 實驗編號 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 到目前為止,由化學能轉變的熱能或電能仍然是人類使用最廣泛的能源.
到目前為止,由化學能轉變的熱能或電能仍然是人類使用最廣泛的能源.| 化學鍵 | H-H | N≡N |
| 鍵能(kJ/mol) | 435 | 943 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若a=b,則容器中可能使用了催化劑或恒溫恒容下充入惰性氣體 | |
| B. | 在該溫度下,保持容積固定不變,向容器內補充了B氣體,則a<b | |
| C. | 若其他條件不變,升高溫度,則a<b | |
| D. | 若保持溫度、壓強不變,充入惰性氣體,則a>b |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H>0,△S>0的反應在所有溫度下都能自發進行 | |
| B. | NH4HCO3(s)=NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自發進行,原因是體系有自發地向混亂度增加的方向轉變的傾向 | |
| C. | △H<0、△S>0的反應在任何溫度下都能自發進行 | |
| D. | 在其他外界條件不變的情況下,使用催化劑,可以改變化學反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳碳間以單鍵結合,碳原子剩余價鍵全部與氫原子結合的烴一定是飽和鏈烴 | |
| B. | 分子組成符合CnH2n+2的烴一定是烷烴 | |
| C. | 正戊烷分子中所有原子均在一條直線上 | |
| D. | CH3CH(CH3)2在光照下與氯氣反應,可以生成四種一氯代烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 雖然藥物能治病,但大部份藥物有毒副作用 | |
| B. | 青霉素有解熱鎮痛的作用 | |
| C. | 阿司匹林是最重要的抗生素 | |
| D. | 隨著藥物的普及,生病了都可以到藥店自己買藥吃,不用到醫院 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com