
(05年江蘇卷)(8分)在一定條件下,烯烴可發生臭氧化還原水解反應,生成羰基化合物,該反應可表示為:
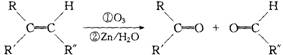
已知:
①化合物A,其分子式為C9H10O,它既能使溴的四氯化碳溶液褪色,又能與FeCl3溶液發生顯色反應,且能與金屬鈉或氫氧化鈉溶液反應生成B;
②B發生臭氧化還原水解反應生成C,C能發生銀鏡反應;
③C催化加氫生成D,D在濃硫酸存在下加熱生成E;
④E既能使溴的四氯化碳溶液褪色,又能與FeCl3溶液發生顯色反應,且能與氫氧化鈉溶液反應生成F;
⑤F發生臭氧化還原水解反應生成G,G能發生銀鏡反應,遇酸轉化為H(C7H6O2)。
請根據上述信息,完成下列填空:
(1)寫出下列化合物的結構簡式(如有多組化合物符合題意,只要寫出其中的一組)
A________________,C_______________,E____________________。
(2)寫出分子式為C7H6O2的含有苯環的所有同分異構體的結構簡_____________。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
(05年江蘇卷)(12分)硫酸亞鐵(FeSO4?7H2O)是一種重要的食品和飼料添加劑。實驗室通過下列實驗由廢鐵屑制備FeSO4?7H2O晶體:
①將5%Na2CO3溶液加入到盛有一定量廢鐵屑的燒杯中,加熱數分鐘,用傾析法除去Na2CO3溶液,然后將廢鐵屑用水洗滌2~3遍;
②向洗滌過的廢鐵屑加入過量的稀硫酸,控制溫度50~80℃之間至鐵屑耗盡;
③趁熱過濾,將濾液轉入到密閉容器中,靜置、冷卻結晶;
④待結晶完畢后,濾出晶體,用少量冰水2~3次,再用濾紙將晶體吸干;
⑤將制得的FeSO4?7H2O晶體放在一個小廣口瓶中,密閉保存。
請回答下列問題:
(1)實驗步驟①的目的是______________,加熱的作用是____________________。
(2)實驗步驟②明顯不合理,理由是_______________________。
(3)實驗步驟④中用少量冰水洗滌晶體,其目的是_____________;_______________。
(4)經查閱資料后發現,硫酸亞鐵在不同溫度下結晶可分別得到FeSO4?7H2O、FeSO4?4H2O和FeSO4?H2O。硫酸亞鐵在不同溫度下的溶解度和該溫度下析出晶體的組成如下表所示(僅在56.7℃、64℃溫度下可同時析出兩種晶體)。
溫度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
析出晶體 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||||
請根據表中數據作出硫酸亞鐵的溶解度曲線。
⑤若從硫酸亞鐵溶液中結晶出FeSO4?4H2O晶體,應控制的結晶溫度(t)的范圍為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
(05年江蘇理綜卷)哈伯因發明了由氮氣和氫氣合成氨氣的方法而獲得1918年諾貝爾化學獎。現向一密閉容器中充人1mol N2和3mol H2,在一定條件下使該反應發生。下列有關說法正確的是()
A 達到化學平衡時,N2將完全轉化為NH3
B 達到化學平衡時,N2、H2和NH3的物質的量濃度一定相等
C 達到化學平衡時,N2、H2和NH3的物質的量濃度不再變化
D 達到化學平衡時,正反應和逆反應的速率都為零
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com