
分析 (1)根據蓋斯定律,將已知反應$\frac{①-②+③×4}{2}$得到CH3OH(l)+O2(g)=CO(g)+2H2O(l)的熱化學方程式;
(2)①反應達到平衡狀態時,正逆反應速率相等,各物質的濃度不變,由此衍生的一些物理量也不變,以此判斷;
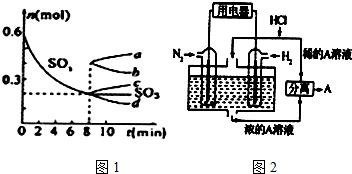
②在容積為1L密閉容器中充入0.6molSO3,由圖1平衡時SO3物質的量為0.2mol,
2SO2 +O2 ?2SO3,
起始量(mol) 0 0 0.6
變化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
轉化率=$\frac{消耗量}{起始量}$×100%;根據K=$\frac{c(S{O}_{3})^{2}}{c(S{O}_{2})^{2}c({O}_{2})}$計算;其他條件不變,在8min時壓縮容器體積至0.5L,平衡向正反應方向移動,n(SO3)變大;
(3)電池中氫氣失電子,在負極發生氧化反應,氮氣得電子在正極發生還原反應,氨氣與HCl反應生成氯化銨,則電解質溶液為氯化銨.
解答 解:(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
將$\frac{①-②+③×4}{2}$得到CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=[(-1275.6kJ/mol)-(-566.0kJ/mol)+(-44.0kJ/mol)×4]÷2=442.8kJ•mol-1,
即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1,
故答案為:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(2)①a.氣體質量不變,體系的密度不發生變化,不能說明反應達到平衡狀態,故a錯誤;
b.氣體質量不變,S元素質量不變,體系中硫元素的質量百分含量不再變化,不能說明反應達到平衡狀態,故b錯誤;
c.SO2與SO3的體積比保持不變,可說明反應達到平衡狀態,故c正確;
d 容器內的氣體分子總數不再變化,說明各物質的濃度不變,說明反應達到平衡狀態,故d正確;
e.任何狀態下,單位時間內轉移4mol 電子,同時消耗2mol SO3,不能說明反應達到平衡狀態,故e錯誤.
故答案為:cd;
②在容積為1L密閉容器中充入0.6molSO3,由圖1平衡時SO3物質的量為0.2mol,
2SO2+O2 ?2SO3,
起始量(mol) 0 0 0.6
變化量(mol) 0.4 0.2 0.4
平衡量(mol) 0.4 0.2 0.2
SO2 表示的化學反應速率為$\frac{\frac{0.4mol}{1L}}{8min}$=0.05mol•L-1•min-1,
SO3的轉化率為=$\frac{0.4}{0.6}$×100%≈66.7%;
K=$\frac{c(S{O}_{3})^{2}}{c(S{O}_{2})^{2}c({O}_{2})}$=$\frac{0.{2}^{2}}{0.{4}^{2}×0.2}$=1.25;
其他條件不變,在8min時壓縮容器體積至0.5L,平衡向正反應方向移動,n(SO3)變大,即為圖象c,
故答案為:0.05mol•L-1•min-1;66.7%;1.25; c;
(3)該電池的本質反應是合成氨反應,電池中氫氣失電子,在負極發生氧化反應,氮氣得電子在正極發生還原反應,則正極反應式為N2+8H++6e-=2NH4+,消耗氫離子,所以電解質溶液的PH增大,氨氣與HCl反應生成氯化銨,則電解質溶液為氯化銨溶液,
故答案為:N2+8H++6e-=2NH4+;增大;NH4Cl.
點評 本題考查較為綜合,為高考常見題型,側重于化學平衡的有關知識、電化學的有關知識的考查,注意外界條件對化學平衡的影響以及有關化學計算,試題較靈活,綜合性強,難度較大.


科目:高中化學 來源: 題型:選擇題
| 溶質 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A. | 四種溶液中,Na2CO3溶液中水的電離程度最大 | |
| B. | 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的濃度 | |
| C. | NaHSO3溶液顯酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | 常溫下,相同物質的量濃度的H2SO3、H2CO3、HClO,pH最小的是H2SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示是一種酸性燃料電池酒精檢測儀,具有自動吹氣流量偵測與控制的功能,非常適合進行現場酒精檢測.下列說法不正確的是( )
如圖所示是一種酸性燃料電池酒精檢測儀,具有自動吹氣流量偵測與控制的功能,非常適合進行現場酒精檢測.下列說法不正確的是( )| A. | 電流由O2所在的鉑電極流出 | |
| B. | 該電池的負極反應式為:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| C. | O2所在的鉑電極處發生還原反應 | |
| D. | 微處理器通過檢測電流大小而計算出被測氣體中酒精的含量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
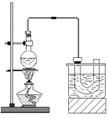 實驗室制備溴乙烷(C2H5Br)的裝置和步驟如下:(已知溴乙烷的沸點38.4℃)①檢查裝置的氣密性,向裝置圖所示的∪形管和大燒杯中加入冰水;②在圓底燒瓶中加入10mL95%乙醇、28mL78%濃硫酸,然后加入研細的13g溴化鈉和幾粒碎瓷片;③小心加熱,使其充分反應.回答下列問題:
實驗室制備溴乙烷(C2H5Br)的裝置和步驟如下:(已知溴乙烷的沸點38.4℃)①檢查裝置的氣密性,向裝置圖所示的∪形管和大燒杯中加入冰水;②在圓底燒瓶中加入10mL95%乙醇、28mL78%濃硫酸,然后加入研細的13g溴化鈉和幾粒碎瓷片;③小心加熱,使其充分反應.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.
研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{b-a}{b}$ | B. | $\frac{2(b-a)}{b}$ | C. | $\frac{3a-2b}{b}$ | D. | $\frac{2b-3a}{b}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com