
| A. | 將5 mL 0.02 mol/L的H2SO4溶液與5 mL 0.02 mol/L NaOH溶液充分混合,若混合后溶液的體積為10 mL,則混合液的pH=2 | |
| B. | 某物質的溶液中由水電離的c(H+)=1×10-amol/L,若a>7,則pH一定為14-a | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小關系:①>③>② | |
| D. | CH3COONa溶液中加入少量KNO3固體后的堿性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
分析 A.酸是二元酸、堿是一元堿,二者體積、濃度相等,則物質的量相等,二者混合后酸有剩余,混合溶液中c(H+)=$\frac{0.02mol/L×0.005L×(2-1)}{0.005L×2}$=0.01mol/L,溶液的pH=-lgc(H+);
B.酸或堿抑制水電離,含有弱離子的鹽促進水電離;
C.pH相同的不同弱酸鈉鹽溶液,酸根離子水解程度越大其溶液濃度越小;
D.任何電解質溶液中都存在電荷守恒和物料守恒,根據電荷守恒和物料守恒判斷.
解答 解:A.酸是二元酸、堿是一元堿,二者體積、濃度相等,則物質的量相等,二者混合后酸有剩余,混合溶液中c(H+)=$\frac{0.02mol/L×0.005L×(2-1)}{0.005L×2}$=0.01mol/L,溶液的pH=-lgc(H+)=-lg0.01=2,故A正確;
B.酸或堿抑制水電離,含有弱離子的鹽促進水電離,某物質的溶液中由水電離的c(H+)=1×10-amol/L,若a>7,說明水電離受抑制,則溶液中溶質為酸或堿,如果溶質為酸,則pH=14-a,如果溶質為堿,則pH=a,故B錯誤;
C.pH相同的不同弱酸鈉鹽溶液,酸根離子水解程度越大其溶液濃度越小,酸根離子水解程度C6H5O->HCO3->CH3COO-,則pH相同的鈉鹽濃度:①>③>②,鈉離子不水解,所以c(Na+)大小關系:①>③>②,故C正確;
D.任何電解質溶液中都存在電荷守恒和物料守恒,根據電荷守恒得c(Na+)+c(H+)+c(K+)=c(NO3-)+c(CH3COO-)+c(OH-),根據物料守恒得c(K+)=c(NO3-),所以得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故D正確;
故選B.
點評 本題考查離子濃度大小比較,為高頻考點,明確溶液中溶質及其性質是解本題關鍵,知道溶液中存在的電荷守恒及物料守恒,易錯選項是BD,注意B中溶質可能是酸也可能是堿,題目難度不大.


 開心口算題卡系列答案
開心口算題卡系列答案 口算題卡河北少年兒童出版社系列答案
口算題卡河北少年兒童出版社系列答案 A加金題 系列答案
A加金題 系列答案科目:高中化學 來源: 題型:選擇題
| A. | 溶質的質量分數為ω=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶質的物質的量濃度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c (OH-)=$\frac{b}{V}$mol•L-1 | |
| D. | 上述溶液中再加入VmL水后,所得溶液的質量分數大于0.5ω |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3是發酵粉的主要成分之一 | B. | MgO常用作耐高溫材料 | ||
| C. | 石灰石可用作工業煉鐵的原料 | D. | 工業上可用Cl2制造漂白粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
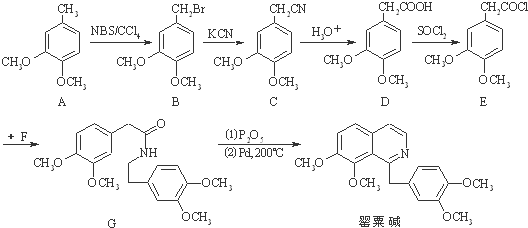
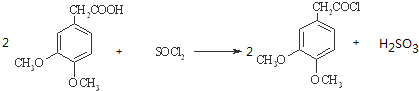 .
.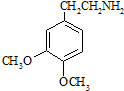 .
.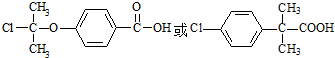 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
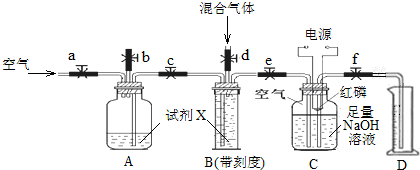
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaBH4中B元素化合價為+3 | B. | 每生成11.2 L氏轉移Na個電子 | ||
| C. | NaBH4在反應中作氧化劑 | D. | NH3BH3在反應中屬于還原產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu(IO3)2作氧化劑,Cu(IO3)2中的銅和碘元素被還原 | |
| B. | CuI既是氧化產物又是還原產物 | |
| C. | 每生成1 mol CuI,有12 mol KI發生氧化反應 | |
| D. | 每轉移1.1 mol電子,有0.2 mol IO3-被氧化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
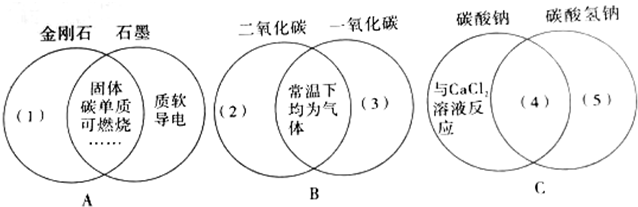
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com