
下列各組離子在溶液中能大量共存的是
A.Na+、Al3+、Cl-、SO42- B.Cu2+、Cl-、NO3-、OH-
C.Ca2+、Na+、CO32-、NO3- D.H+、SO42-、NO3-、OH-
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年江蘇省高二上期中必修化學卷(解析版) 題型:選擇題
 環境污染已成為人類社會面臨的重大威脅,各種污染數不勝數。下列名詞與環境污染無關的是( )
環境污染已成為人類社會面臨的重大威脅,各種污染數不勝數。下列名詞與環境污染無關的是( )
A.白色垃圾  B.酸雨 C.綠色化學 D.臭氧層空洞
B.酸雨 C.綠色化學 D.臭氧層空洞
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江大慶一中高二上11月月考化學卷(解析版) 題型:選擇題
常溫下,下列各組離子在指定溶液中一定能大量共存的是
A.0.1mol/L FeCl3溶液:K+、NH4+、SCN-、NO3-
B.0.1mol/LCu(NO3)2溶液:Na+、Mg2+、Cl-、SO42-
C.0.5mol/L AlCl3溶液:K+、Na+、S2-、SO42-
D.由水電離產生的c(H+)=10-13 mol·L-1的溶液:K +、Na+、HCO3-、Cl-
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上期中化學試卷(解析版) 題型:實驗題
實驗室配制480Ml0.1mol/LNa2CO3溶液,請回答下列問題:
(1)配制480Ml0.1mol/LNa2CO3溶液時,需要Na2CO3固體的質量為________g。
(2)配制過程中所需的儀器除藥匙、天平、燒杯、量筒、玻璃棒、膠頭滴管外,還需要________儀器。若在稱量樣品時,藥品放在天平右盤上,砝碼放在天平左盤上,1g以下用游碼,天平平衡時,則實際稱量的十水合碳酸鈉質量________(填符號 A偏高 B偏低 C不變)
(3)配制時,其正確的操作順序是_______(天字母);
A、用30mL蒸餾水洗滌燒杯和玻璃棒各2-3次,洗滌液均注入容量瓶中,震蕩
B、用托盤天平準確稱量所需的Na2CO3的質量,放入燒杯中,再加入少量蒸餾水(約30mL),用玻璃棒慢慢攪動,使其完全溶解
C、將已冷卻至室溫的Na2CO3溶液沿玻璃棒注入一定規格的容量瓶中
D、將容量瓶蓋緊,震蕩,搖勻
E、改用膠頭滴管滴加蒸餾水,使溶液凹液面最低點恰好與刻度線相切
F、繼續往容量瓶內加入蒸餾水,直到液面距刻度線1~2㎝處
(4)若出現以下情況,對所配溶液濃度將有何影響(填“偏高”、“偏低”或“無影響”)?
①沒有進行A操作____________。
②家蒸餾水時不慎超過了刻度線____________。
③定容時俯視刻度線____________。
④溶液未恢復至室溫就注入容量瓶____________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上期中化學試卷(解析版) 題型:選擇題
為了除去粗鹽中的Ca2+、Mg2+、SO42-及泥沙,可將粗鹽溶于水,然后進行下列五項操作:①過濾,②加過量NaOH溶液,③加適量鹽酸,④加過量Na2CO3溶液,⑤加過量BaCl2溶液。正確的操作順序是
A.①④②⑤③ B.④①②⑤③ C.②⑤④③① D.⑤②④①③
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上期中化學試卷(解析版) 題型:選擇題
下列配制的溶液濃度偏高的是
A.配制鹽酸溶液,用量筒量取鹽酸時俯視刻度線
B.配制鹽酸溶液定容時,仰視容量瓶
C.稱量40gNaOH配制0.20mol/LNaOH溶液500mL時,砝碼錯放左盤
D.配制NaOH溶液時,溶液未經冷卻即注入容量瓶并定容至刻度線
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上月考二化學卷(解析版) 題型:選擇題
下列關于電解質的理解中錯誤的是
A.電解質、非電解質都對化合物而言,單質不屬于此范疇
B.一種物質是不是電解質與其所處的狀態無關
C.在水溶液里或熔融狀態下,因其自身電離而導電的化合物叫做電解質
D.電解質在任何條件下都能導電
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山西省高一上月考二化學卷(解析版) 題型:選擇題
已知下列分子或離子在酸性條件下都能氧化KI,自身發生如下變化:H2O2→H2O,IO3-→I2,MnO4-→Mn2+,HNO3→NO。如果分別用等物質的量的這些物質氧化足量的KI,得到I2最多的是
A.H2O2 B.IO3- C.MnO4- D.HNO3
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上期中理化學卷(解析版) 題型:填空題
在25℃時,對于0.1mol·L-1的氨水,請回答以下問題。
(1)若向氨水中加入少量硫酸銨固體,此時溶液中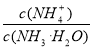 將_________(填“增大”、“減小”或“不變”);
將_________(填“增大”、“減小”或“不變”);
(2)若向氨水中加入pH=1的硫酸,且氨水與硫酸的體積比為1:1,此時溶液的pH_________7(填“>”、“<”或“=”),用離子方程式表示其原因______________,此時溶液中各離子濃度由大到小的順序為_______________。
(3)若向氨水中加入0.05mol•L-1稀硫酸至溶液正好呈中性,所用氨水的體積V1與稀硫酸的體積V2的關系為V1_________V2(填“大于”、“小于”或“等于”),寫出溶液中各離子濃度之間滿足的電荷守恒表達式______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com