
【題目】一定溫度范圍內用氯化鈉熔浸鉀長石(主要成份為KAlSi3O8)可制得氯化鉀,主要反應是:NaCl(l)+KAlSi3O8(s)![]() KCl(l)+NaAlSi3O8(s) △H=-Q kJ/mol。
KCl(l)+NaAlSi3O8(s) △H=-Q kJ/mol。
(1)寫出Cl原子的核外電子排布式_______, NaCl的熔點比KCl______ (選填“高”或“低”)。
(2)指出鉀長石中存在的化學鍵類型__________________。
(3)上述反應涉及的位于同一周期的幾種元素中,有一種元素的最高價氧化物的水化物和其余元素的最高價氧化物的水化物均能發生反應,該元素是_______。
【答案】1s22s22p63s23p5 高 離子鍵、共價鍵 Na
【解析】
(1)Cl是17號元素,結合構造原理書寫其核外電子排布式;根據晶格能大小判斷物質的熔沸點;
(2)根據形成化學鍵的元素分析判斷;
(3)結合元素及其化合物的性質分析判斷。
(1)Cl所含質子數為17,原子核外電子數為17,根據能量最低原則、泡利不相容原理和洪特規則核外電子排布式為1s22s22p63s23p5;
離子晶體的晶格能大小取決于離子半徑的電荷的因素,離子半徑越小,電荷越多,晶格能越大,離子晶體的熔點越高,鈉離子半徑小于鉀離子半徑,則熔點大小為:NaCl>KCl;
(2)根據質量守恒,將鉀長石用氧化物的形式表示為K2OAl2O36SiO2,鉀長石(KAlSi3O8)中即含有金屬與非金屬元素形成的離子鍵,也含有非金屬元素之間形成的共價鍵;
(3)上述反應涉及的位于同周期元素有Na、Al、Si、Cl,元素的最高價氧化物的水化物和其余元素的最高價氧化物的水化物均能發生反應為NaOH,該物質是堿,Al(OH)3是兩性氫氧化物,能夠與強堿NaOH發生反應;H2SiO3、HClO4是酸,能夠與堿NaOH發生反應,故該元素是Na。


科目:高中化學 來源: 題型:
【題目】常溫下,將0.02mol/LMOH溶液逐滴滴入100mL0.01mol/LHA溶液中,溶液pH隨滴入MOH溶液的體積變化如圖所示。若忽略溶液混合時的體積變化,下列敘述正確的是( )
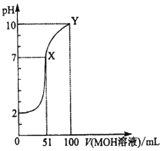
A.溫度不變,滴入MOH溶液的過程中水的電離程度不變
B.X點MOH過量,故溶液中c(M+)>c(A-)
C.HA為弱酸,MOH為強堿
D.Y點的c(MOH)+c(M+)=0.01mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫氧化物易引起環境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工業中,作為催化劑的 V2O5對反應 I 的催化循環過程經歷了Ⅱ、Ⅲ兩個反應階段,如圖所示:

寫出 V2O5·SO3參加反應Ⅲ的化學方程式_____。
(2)將 2molSO2和 1molO2充入密閉容器中,在一定條件下發生反應:2SO2(g)+O2(g)2SO3(g)。平衡時 SO3的體積分數(% )隨溫度和壓強的變化如表所示:
1.0 | 2.0 | 3.0 | |
350 | 54.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
下列判斷正確的是______________
A.b >e
B.415℃、2.0MPa時O2的轉化率為60%
C.在一定溫度和壓強下,加入 V2O5作催化劑能加快反應速率,提高 SO3 的體積分數
D.平衡常數 K(550℃)>K(350℃)
(3)較純的 SO2,可用于原電池法生產硫酸。圖中離子交換膜是___________離子交換膜(填“陰”、“陽”)
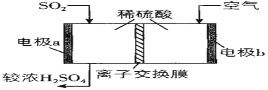
(4)研究發現含堿式硫酸鋁的溶液與SO2 結合的方式有2種:其一是與溶液中的水結合。其二是與堿式硫酸鋁中的活性Al2O3結合,通過酸度計測定吸收液的pH變化,結果如圖所示:

請解釋曲線如圖變化的原因____
(5)取五等份SO3,分別加入溫度不同、容積相同的恒容密閉容器中,發生反應:3SO3(g)(SO3)3(g) △H<0,反應相同時間后,分別測定體系中SO3的百分含量,并作出其隨反應溫度(T)變化的關系圖。下列示意圖中,可能與實驗結果相符的是________________
A.  B.
B.  C.
C.  D.
D. 
(6)用 Na2SO3 溶液作為吸收液吸收 SO2 時,產物為 NaHSO3,已知亞硫酸的兩級電離平衡常數分別為 K a1、K a2。則常溫下 NaHSO3溶液顯酸性的充要條件為_____。(用含為 Ka1、Ka2 的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將反應Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)設計成原電池,某一時刻的電子流向及電流計(G)指針偏轉方向如圖所示,下列有關敘述正確的是( )

A、KNO3鹽橋中的K+移向Cu(NO3)2溶液
B、Cu作負極,發生還原反應
C、電子由AgNO3溶液通過鹽橋移向Cu(NO3)2溶液
D、工作一段時間后,AgNO3溶液中c(Ag+)減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】肉桂酸是香料、化妝品、醫藥、塑料和感光樹脂等的重要原料.實驗室用下列反應制取肉桂酸.
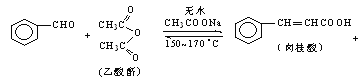 CH3COOH
CH3COOH
藥品物理常數
苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
溶解度(25℃,g/100g水) | 0.3 | 遇熱水水解 | 0.04 | 互溶 |
沸點(℃) | 179.6 | 138.6 | 300 | 118 |
填空:
合成:反應裝置如圖所示.向三頸燒瓶中先后加入研細的無水醋酸鈉、苯甲醛和乙酸酐,振蕩使之混合均勻. 在150~170℃加熱1小時,保持微沸狀態.
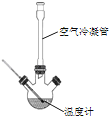
(1)空氣冷凝管的作用是__.
(2)該裝置的加熱方法是__.加熱回流要控制反應呈微沸狀態,如果劇烈沸騰,會導致肉桂酸產率降低,可能的原因是______.
(3)不能用醋酸鈉晶體(CH3COONa3H2O)的原因是______.
粗品精制:將上述反應后得到的混合物趁熱倒入圓底燒瓶中,進行下列操作:
反應混合物![]()
![]()
![]()
![]()
![]() 肉桂酸晶體
肉桂酸晶體
(4)加飽和Na2CO3溶液除了轉化醋酸,主要目的是_______.
(5)操作I是__;若所得肉桂酸晶體中仍然有雜質,欲提高純度可以進行的操作是__(均填操作名稱).
(6)設計實驗方案檢驗產品中是否含有苯甲醛_______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,容積一定的密閉容器中發生反應A(s)+2B(g)![]() C(g)+D(g),當下列物理量不再發生變化時,表明反應已達平衡的是
C(g)+D(g),當下列物理量不再發生變化時,表明反應已達平衡的是
①混合氣體的密度 ②混合氣體的壓強 ③B的物質的量濃度 ④混合氣體的總物質的量
A. ①② B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某有機物分子中C、H、O、N四種原子的成鍵方式示意圖(短線表示單鍵或者雙鍵)。下列關于該有機物的說法正確的是
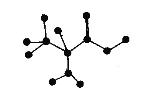
A.在一定條件下,可以通過聚合反應生成高分子化合物
B.分子式為C3H6NO2
C.能和NaOH溶液反應,但不能和鹽酸溶液反應
D.不能和NaHCO3溶液反應生成CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氣是化工生產的主要原料之一,氨氣的用途非常廣泛。在一固定容積為2 L的密閉容器內加入0.2 mol的N2和0.6 mol的H2,發生如下反應: N2(g)+3H2(g)![]() 2NH3(g)△H=-Q kJ/mol(Q>0)。
2NH3(g)△H=-Q kJ/mol(Q>0)。
(1)該反應所用的催化劑是_______(填寫名稱);該反應450℃時的平衡常數______500℃時的平衡常數(填“>”、“<”或“=”)。
(2)下列描述中能說明上述反應已達平衡的是_______
A. 3v正(H2)=2v逆(NH3) B.容器中氣體的平均分子量不隨時間而變化
C.容器中氣體的密度不隨時間而變化 D.容器中氣體的分子總數不隨時間而變化
(3)上述反應若第5分鐘時達到平衡,測得NH3的物質的量為0.2 mol計算從反應開始到平衡時,平均反應速率v(N2)為______________。
(4)在另一容積可變的容器內加入0.2 mol的N2和0.6 mol的H2,在相同條件下發生上述反應,則產生的NH3的物質的量比原平衡產生的NH3______(填“多”或“少”或”“一樣”)。
(5)工廠生產的氨水稀釋后可作肥料。稀釋氨水時,隨著水的增加溶液中減少的是_______
a.  b.
b. 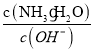 c.
c. 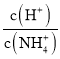 d.
d. 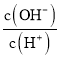
(6)液氨和水類似,也能電離:2NH3![]() NH4++ NH2-,某溫度時,其離子積K=2×l0-30。該溫度下:①將少量NH4Cl固體加入液氨中,K____2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某溫度時,其離子積K=2×l0-30。該溫度下:①將少量NH4Cl固體加入液氨中,K____2×10-30(填“<”、“>”或“=”);
②將少量金屬鈉投入液氨中,完全反應后所得溶液中各微粒的濃度大小關系為:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關鍵環節考核:
(1)將AgNO2和AgCl的飽和溶液等體積混合后,加入足量的硝酸銀溶液,生成的沉淀n(AgNO2)________n(AgCl)(填“大于”、“小于”或“等于”)。(已知該溫度下,Ksp(AgNO2)=2×10-8;Ksp(AgCl)=1.8×10-10)
(2)CaSO3溶液與CaCl2溶液混合會生成難溶的CaSO3(Ksp=3.1×10-7),現將等體積的CaCl2溶液與Na2SO3溶液混合,若混合前Na2SO3溶液濃度為2×10-3 mol·L-1,則生成沉淀所需CaCl2溶液的最小濃度為__________________。
學法題:通過上題第(2)問的計算,請思考利用溶度積常數(Ksp)進行定量計算,代入離子濃度時需要注意的關鍵是什么?__________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com