
【題目】某氯化鐵(FeCl3)樣品含有少量FeCl2雜質。現要測定其中鐵元素的質量分數,實驗按以下步驟進行,根據流程回答以下問題:
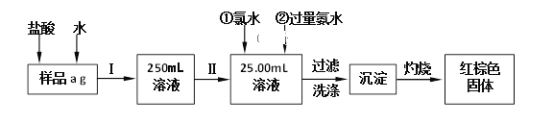
(1)操作I是配制溶液,所用到的玻璃儀器除燒杯、玻璃棒外,還必須有_______、_______。
(2)寫出加入氯水發生的離子反應方程式________________________________。
(3)寫出加入過量氨水發生的離子反應方程式_______________________________。
(4)寫出灼燒發生反應的化學方程式_______________________________。
(5)檢驗沉淀是否已經洗滌干凈的操作是______________________________。
(6)下列操作可能使所配溶液濃度偏小的是__________(填寫序號)。
①未洗滌燒杯和玻璃棒
②定容時俯視容量瓶的刻度線
③配溶液前容量瓶中有少量蒸餾水
④搖勻后,發現液面低于刻度線后繼續加水至凹液面與刻度線相切
(7)若原樣品質量a為10g,加熱后紅棕色固體質量是0.6g,則樣品中鐵元素的質量分數是_____________。
【答案】250mL容量瓶 膠頭滴管。 2Fe2++Cl2==2Fe3++2Cl— Fe3++3NH3H2O= Fe(OH)3↓+3NH4+ 2Fe(OH)3![]() Fe2O3+3H2O 取最后一次洗滌液少許,加入硝酸酸化的硝酸銀溶液,若產生白色沉淀則沒有洗滌干凈;若沒有產生白色沉淀則洗滌干凈。 ①④ 42%
Fe2O3+3H2O 取最后一次洗滌液少許,加入硝酸酸化的硝酸銀溶液,若產生白色沉淀則沒有洗滌干凈;若沒有產生白色沉淀則洗滌干凈。 ①④ 42%
【解析】
本實驗目的是測定鐵的質量分數,采取的方法是使樣品溶解、反應、最終生成氧化鐵,然后通過氧化鐵質量來求鐵的質量分數;
(1) 根據配制一定物質的量濃度的溶液所需要的儀器有:量筒、膠頭滴管、燒杯、玻璃棒、一定規格的容量瓶;
(2) 根據Cl2具有氧化性,能氧化Fe2+;
(3)加入過量氨水的目的是將溶液中的Fe3+完全轉化為Fe(OH)3沉淀;
(4) Fe(OH)3受熱分解生成Fe2O3和水;
(5) 取最后一次洗滌液少許,加入硝酸酸化的硝酸銀溶液,若產生白色沉淀則沒有洗滌干凈;若沒有產生白色沉淀則洗滌干凈;
(6) 依據溶液配制過程和實驗步驟分析判斷選項中,根據c=![]() =
=![]() 來分析各操作對濃度的影響;
來分析各操作對濃度的影響;
(7) 加熱分解所得的物質是Fe2O3,其質量為0.6g,由于取的25mL溶液,故250mL溶液可以得到Fe2O3質量為6g,根據化學式計算鐵元素的質量,再利用質量分數的定義計算原氧化鐵樣品中鐵元素的質量分數。
實驗目的為測定鐵的質量分數,采取的方法是使樣品溶解、反應、最終生成氧化鐵,然后通過氧化鐵質量來求鐵的質量分數;
(1)因配制一定物質的量濃度的溶液所需要的儀器有:量筒、膠頭滴管、燒杯、玻璃棒、一定規格的容量瓶,配制250mL溶液時還缺少250mL容量瓶和膠頭滴管;
(2)因Cl2具有氧化性,能氧化Fe2+,發生反應的離子方程式為2Fe2++Cl2=2Fe3++2Cl-;
(3)加入過量氨水的目的是將溶液中的Fe3+完全轉化為Fe(OH)3沉淀,發生的離子反應方程式Fe3++3NH3H2O= Fe(OH)3↓+3NH4+;
(4)灼燒是Fe(OH)3分解生成Fe2O3和水,發生反應的化學方程式為2Fe(OH)3![]() Fe2O3+3H2O;
Fe2O3+3H2O;
(5) 最后一次洗出液,滴加AgNO3溶液,若無沉淀生成,可證明洗滌干凈,
(6) 依據溶液配制過程和實驗步驟分析判斷選項,根據c=![]() =
=![]() 來
來
①未洗滌燒杯和玻璃棒,溶質未全部轉移到容量瓶,使得m減少,濃度偏低,故①正確;
②定容時俯視容量瓶的刻度線,容量瓶中水未加到刻度線,使得V偏小,濃度偏大,故②錯誤;
③配溶液前容量瓶中有少量蒸餾水對配制溶液濃度無影響,故③錯誤;
④搖勻后,發現液面低于刻度線后繼續加水至凹液面與刻度線相切,使得V偏大,溶液濃度偏小,故④正確;
故答案為:①④;
(7) 加熱分解所得的物質是Fe2O3,其質量為0.6g,由于取的25mL溶液,故250mL溶液可以得到Fe2O3質量為6g,依據鐵元素守恒計算鐵元素的質量分數= 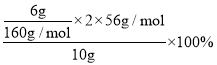 =42%。
=42%。


科目:高中化學 來源: 題型:
【題目】向密閉容器中充入物質A和B,發生反應aA(g)+bB(g)![]() cC(g)。反應過程中,物質A的體積分數和C的體積分數隨溫度(T)的變化曲線如圖所示,下列說法正確的是( )
cC(g)。反應過程中,物質A的體積分數和C的體積分數隨溫度(T)的變化曲線如圖所示,下列說法正確的是( )
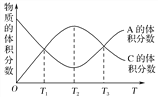
A. 該反應在T1、T3溫度時達到化學平衡
B. 該反應在T2溫度時達到化學平衡
C. 該反應的逆反應是放熱反應
D. 升高溫度,平衡會向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列裝置或操作能達到目的的是( )
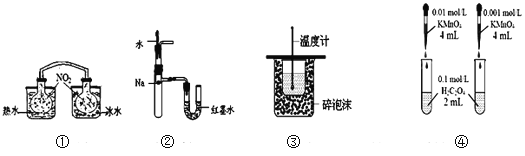
A. 裝置①依據兩容器內氣體顏色變化,不能判斷反應2NO2(g)![]() N2O4(g)平衡移動的方向
N2O4(g)平衡移動的方向
B. 裝置②依據U管兩邊液面的高低判斷Na和水反應的熱效應
C. 裝置③測定中和熱
D. 裝置④依據褪色快慢比較濃度對反應速率的影響
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學們按照下面的實驗方法制備氫氧化鐵膠體:首先取少量蒸餾水于潔凈的燒杯中,用酒精燈加熱至沸騰,向燒杯中逐滴滴加飽和的FeCl3溶液繼續煮沸,至液體呈透明的紅褐色。
(1)發生反應的化學方程式為______,判斷膠體制備是否成功,可利用膠體的____________ 。
(2)在做制備氫氧化鐵膠體的實驗時,有些同學沒有按要求進行,結果沒有觀察到膠體,請你預測其現象并分析原因:
①甲同學沒有選用飽和氯化鐵溶液,而是將稀氯化鐵溶液滴入沸水中,結果沒有觀察到_____,其原因是______________
②乙同學在實驗中沒有使用蒸餾水,而是用自來水,結果會__________,原因是___________
③丙同學向沸水中滴加飽和氯化鐵溶液后,長時間加熱,結果會_________,原因是________
(3)丁同學按要求制備了Fe(OH)3膠體,但是他又向Fe(OH)3膠體中逐滴加入了稀H2SO4溶液,結果出現了一系列變化。
①先出現紅褐色沉淀,原因是_______________________________________
②隨后沉淀溶解,此反應的離子方程式是___________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅還原四氯化硅是一種有著良好應用前景的制備硅的方法,該制備過程示意圖如下:
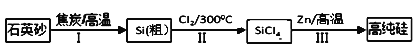
(1)1mol焦炭在過程Ⅰ中失去____mol電子。
(2)過程Ⅱ中Cl2用電解飽和食鹽水制備,制備Cl2的離子方程式為________。
(3)步驟(2)中的電解過程中,若用甲醇燃料電池作電源,用KOH作電解質,負極反應為_________。
(4)整過生產過程必須嚴格控制無水,回答下列問題:
①SiCl4遇水劇烈水解生成SiO2和一種酸,化學反應方程式為_________。
②干燥Cl2時從有利于充分干燥和操作安全的角度考慮,需將約90℃的潮濕氯氣先冷卻至12℃,然后再通入濃H2SO4中。冷卻的作用是_________。
(5)Zn還原SiCl4的可逆反應如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列說法正確的是(___)
Si(S)+2ZnCl2(g)△H<0下列說法正確的是(___)
A.還原過程需在無氧的氣氛中進行 |
B.投入1molZn可生成14g還原產物 |
C.增加SiCl4(g)的量,該反應平衡常數不變 |
D.若SiCl4(g)過量可增大△H的值 |
(6)有一種由硅制作的材料中常加入Ag2SO4 ,已知某溫度下Ag2SO4(M=312g/mol)的溶解度為0.624g/100g H2O,該溫度下Ag2SO4的Ksp=_______(兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室從含碘廢液(除H2O外,含有CCl4、I2、I等)中回收碘,其實驗過程如下:
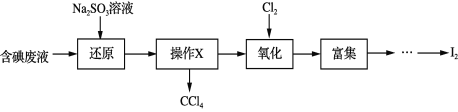
下列敘述不正確的是
A. “操作X”的名稱為萃取,可在分液漏斗中進行
B. “還原”步驟發生的反應為:SO32+I2+H2O == 2I+SO42+2H+
C. “氧化”過程中,可用雙氧水替代氯氣
D. “富集”即I2富集于有機溶劑,同時除去某些雜質離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】少量鐵粉與![]() 的稀鹽酸反應,反應速率太慢。為了加快此反應速率而不改變
的稀鹽酸反應,反應速率太慢。為了加快此反應速率而不改變![]() 的產量,可以使用如下方法中的( )
的產量,可以使用如下方法中的( )
①加![]() ②加
②加![]() 固體 ③滴入幾滴濃鹽酸
固體 ③滴入幾滴濃鹽酸
④改用![]() 的硝酸 ⑤加
的硝酸 ⑤加![]() 溶液 ⑥滴加幾滴硫酸銅溶液
溶液 ⑥滴加幾滴硫酸銅溶液
⑦升高溫度(不考慮鹽酸揮發) ⑧改用![]() 的鹽酸
的鹽酸
A. ③⑤⑥⑦B. ③⑦⑧C. ③⑥⑦⑧D. ③④⑥⑦⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一鐵的氧化物樣品,用140 mL 5 mol·L-1的鹽酸恰好完全溶解,所得溶液還能與通入的0.56 L氯氣(標準狀況)反應,使Fe2+全部轉化為Fe3+,則此氧化物為
A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O7
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com