
(15分)開發新型儲氫材料是氫能利用的重要研究方向。
(1)化合物A(H3BNH3)是一種潛在的儲氫材料,可由六元環狀物質(HB=NH)3通過如下反應制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。請回答:
①H3BNH3中是否存在配位鍵 (填“是”或“否”),B、C、N、O第一電離能由大到小的順序為 ,CH4、H2O、CO2三分子按照鍵角由大到小的順序排列為 。
②與(HB=NH)3互為等電子體的分子為 (填分子式)
③人工可以合成硼的一系列氫化物,其物理性質與烷烴相似,故稱之為硼烷。工業上可采用LiAlH4和BCl3在一定條件下制備乙硼烷B2H6,該反應的化學方程式為 。
④在硼酸鹽中,陰離子有鏈狀、環狀、骨架狀等多種結構形式。圖a為一種無限長鏈狀結構的多硼酸根,其化學式為 ,圖b為硼砂晶體中陰離子,其中硼原子采取的雜化方式為 。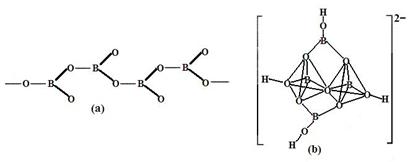
(2)一種銅合金具有儲氫功能
①Cu2+的價層電子排布式為 。
②銅及其它許多金屬及其化合物都可以發生焰色反應,其原因是 。
③銅的單質中按ABCABC……方式堆積,設銅原子半徑為a pm,則該晶體的密度為 g/cm3(阿伏伽德羅常數值為NA)
(1)①是,N>O>C>B CO2>CH4>H2O;②C6H6 ;③4BCl3+3LiAlH4=2B2H6+3LiCl+3AlCl3
(或4BCl3+3LiAlH4=2B2H6+3LiAlCl4)④BO2--;sp3、sp2;(2)①3d9;②激發態的電子從能量較高的軌道躍遷到能量較低的軌道時,以一定波長的光的形式釋放能量;③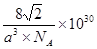 。
。
解析試題分析:(1)①在H3BNH3中的B與N原子之間存在配位鍵;B、C、N、O是同一周期的元素。一般情況下,元素的非金屬性越強,原子半徑越小,元素的第一電離能既有越大,但是由于N原子的2p軌道上的電子處于半充滿的穩定狀態,所以其電離能比O還大。因此第一電離能由大到小的順序N>O>C>B;CH4是正四面體結構,鍵角109°28′;H2O是V型分子,鍵角104.3°,CO2是直線型分子,鍵角為180°。因此這三分子按照鍵角由大到小的順序排列為CO2>CH4>H2O;②等電子體是原子數等,最外層電子數也相等的物質。與(HB=NH)3互為等電子體的分子為C6H6 ;③根據題意可得合成乙硼烷B2H6,的化學方程式為4BCl3+3LiAlH4=2B2H6+3LiCl+3AlCl3;也可寫作4BCl3+3LiAlH4=2B2H6+3LiAlCl4。④多硼酸根的化學式為BO2--;在圖b硼原子采取的雜化方式為sp3、sp2;(2)①Cu是29號元素,Cu2+的價層電子排布式為3d9;②銅及其它許多金屬及其化合物都可以發生焰色反應的原因是在灼燒時原子中的電子吸收能量,從基態躍遷到激發態。但是激發態是不穩定的,激發態的電子從能量較高的軌道躍遷到能量較低的軌道時,以一定波長的光的形式釋放能量;③Cu是面心立方緊密堆積,在一個晶胞中含有的Cu原子的個數為:8×1/8+6×1/2="4;" 設銅原子半徑為a pm.晶胞的邊長L.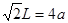 ;L=2
;L=2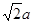 ;該晶體的密度為
;該晶體的密度為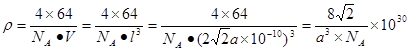 g/cm3.
g/cm3.
考點:考查配位鍵、原子的雜化方式、等電子體、電離能的比較、焰色反應的原因及晶體密度的計算。


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:填空題
(10分)下表為元素周期表中的一部分.用化學式或元素符號回答下列問題:
| | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | ⑨ | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)現有A、B、C、D、E、F、G、H八種短周期主族元素,原子序數依次增大。已知A與E、D與G分別同主族;E、F、G、H同周期;A分別與C、D可形成含有10個電子的共價化合物M、N;B的最外層電子數是其電子層數的2倍;D是地殼中含量最多的元素;F位于B的前一主族。請回答下列問題:
(1)元素B在周期表中的位置 ,M的空間構型是 。
(2)A、D、E三種元素組成一種常見化合物,W與該化合物的陰離子具有相同的原子種類和數目且不帶電,W的電子式為 ,工業上利用某一個反應可同時生產該化合物和H的單質,寫出該反應的化學方程式 。
(3)E、F元素的最高價氧化物對應的水化物之間反應的離子方程式 。
(4)M、N均能結合H+,其中結合H+能力較強的是 (填化學式),用離子方程式證明 。
(5)E分別與D、G形成摩爾質量相等的化合物X、Y,其中Y的水溶液顯堿性的原因是 (用離子方程式表示)。常溫下7.8 g X與水反應放出Q kJ熱量(Q>0),寫出該反應的熱化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)Q、W、X、Y、Z是原子序數依次增大的短周期元素,X、Y是金屬元素,Q、W、Z是非金屬元素。五種元素核電荷數之和為55,對應原子最外層電子數之和為21。W、Z最外層電子數相同,但Z的核電荷數是W的2倍。
(1)Q在周期表中位于第 周期 族。
(2)X、Y各自的最高價氧化物對應的水化物可以發生反應生成鹽和水,請寫出該反應的離子方程式: 。
(3)X單質能在W單質中燃燒可生成化合物R,R的電子式 ___,該物質所含有的化學鍵的類型為 。
(4)Z的氫化物與W的氫化物發生反應生成Z單質和水,寫出其化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)已知A、B、C、D、E都是周期表中前四周期的元素,它們的核電荷數依次增加。相關信息如下表所示,根據推斷回答下列問題:(答題時A、B、C、D、E用所對應的元素符號表示)
| A | A的最高價氧化物對應的水化物化學式為H2AO3 |
| B | B元素的第一電離能比同周期相鄰兩個元素都大 |
| C | C原子在同周期原子中半徑最大(稀有氣體除外),其單質焰色為黃色 |
| D | Z的基態原子最外層電子排布式為3s23p2 |
| E | E與C位于不同周期,E原子核外最外層電子數與C相同,其余各層電子均充滿 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(24分)下表是元素周期表的一部分,針對表中①~⑩種元素,填寫下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | ⑤ | ⑥ | ⑦ | | | | ⑧ | |
| 4 | ⑨ | ⑩ | | | | | | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下表為元素周期表的一部分,請參照元素①~⑧在表中的位置,回答下列問題: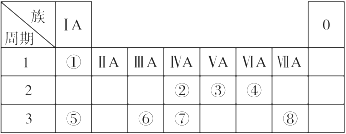
(1)在以上元素的原子中,原子半徑最大的是 (填元素符號)。
(2)地殼中含量居于第二位的元素在周期表中的位置是 。
(3)①、④、⑤中的某些元素可形成既含離子鍵又含共價鍵的離子化合物,寫出兩種化合物的電子式 、 。
(4)W是第四周期與④同主族的元素。據此推測W不可能具有的性質是 。
| A.最高正化合價為+6價 | B.氣態氫化物比H2S穩定 |
| C.最高價氧化物的水化物的酸性比硫酸弱 | D.單質在常溫下可與氫氣化合 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下表是元素周期表的一部分, 針對表中的①~⑨種元素,填寫下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
四種短周期元素W、X、Y、Z,原子序數依次增大,請結合表中信息回答下列問題。
| | W | X | Y | Z |
| 結構或性質 | 最高價氧化物對應的水化物與其氣態氫化物反應得到離子化合物 | 焰色反應呈黃色 | 在同周期主族元素形成的簡單離子中,離子半徑最小 | 最高正價與最低負價之和為零 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com