
【題目】下列反應中,氧化劑與還原劑化學計量數為1:2的是( )
A.Fe+2HCl═FeCl2+H2↑
B.2HCl+Ca(ClO)2═2HClO+CaCl2
C.I2+2NaClO3═2NaIO3+Cl2↑
D.4HCl(濃)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 99加1領先期末特訓卷系列答案
99加1領先期末特訓卷系列答案 百強名校期末沖刺100分系列答案
百強名校期末沖刺100分系列答案 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:
【題目】在一定溫度下,10L密閉容器中加入5molSO2、4.5molO2 , 經10min后反應達平衡時,有3molSO2發生了反應.試回答下列問題:
(1)O2的轉化率為多少?
(2)用SO2表示該反應的反應速率為多少?
(3)平衡時容器內氣體壓強與反應前的壓強之比為多少?(最簡整數比)
(4)平衡時體系中SO3的百分含量(體積分數)為多少?
(5)平衡常數K為多少?
(6)若向平衡混合物的容器中通人少量氦氣后,化學平衡如何移動?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列條件一定能使反應速率加快的是
①增加反應物的物質的量②升高溫度③縮小反應容器的體積④加入生成物⑤加入MnO2
A. 全部B. ①②⑤C. ②D. ②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知實驗室制氫氣的反應:Zn+2HCl=ZnCl2+H2↑.現用13.0gZn粉與一定量2mol/L稀鹽酸充分反應,一段時間后Zn粉無剩余.
(1)用雙線橋或單線橋標出電子轉移的方向和數目
(2)比較H+和Zn2+氧化性強弱
(3)消耗鹽酸的體積至少為多少升?
(4)生成ZnCl2的物質的量為多少?
(5)標準狀況下,最多能收集到多少升氣體?
(6)反應中轉移的電子的個數.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有金屬單質A和氣體甲、乙、丙及物質B、C、D、E、F、G,它們之間能發生如圖反應(圖中有些反應的產物和反應的條件沒有全部標出).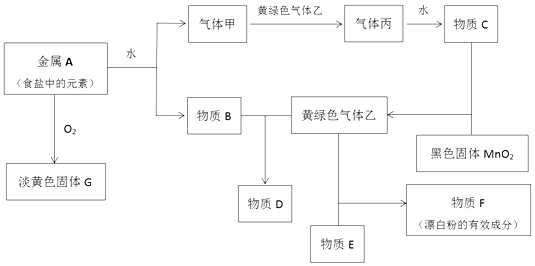
請根據以上信息回答下列問題:
(1)實驗室制取氯氣的化學方程式為4HCl(濃)+MnO2 ![]() Cl2↑+MnCl2+2H2O,
Cl2↑+MnCl2+2H2O,
MnO2 做劑,如果反應產生的氣體在標況下體積為2.24L,則被氧化的HCl的物質的量是mol
(2)寫出下列反應的離子方程式:
①金屬A和水
②物質B和氣體乙
(3)用兩個化學方程式表示固體G可做呼吸系統供氧劑原因
(4)用化學方程式解釋F長期放置在空氣中失效的原因:
(5)紅熱細鐵絲能在氣體乙劇烈燃燒,現象是將燃燒產物配成飽和溶液滴入沸水中可以得到的氫氧化鐵膠體,該氫氧化鐵膠體粒子直徑在
之間.向氫氧化鐵膠體中滴入過量稀硫酸,現象是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機化合物A的相對分子質量(分子量)大于110,小于150.經分析得知,其中碳和氫的質量分數之和為52.24%,其余為氧.請回答:
(1)該化合物分子中含有個氧原子,為什么?
(2)該化合物的相對分子質量(分子量)是 .
(3)該化合物的化學式(分子式)是 .
(4)該化合物分子中最多含個 ![]() 官能團.
官能團.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能正確表示下列反應的離子方程式的是( )
A.向Fe(NO3)2稀溶液中加入鹽酸:3Fe2++4H++NO3﹣=3Fe3++2H2O+NO↑
B.銅與濃硝酸反應:Cu+NO3﹣+4H+=Cu2++NO↑+2H2O
C.氯化銨溶液和濃氫氧化鈉溶液混合后加熱:NH4++OH﹣ ![]() NH3H2O
NH3H2O
D.碳酸氫銨溶液與足量氫氧化鈉溶液混合后加熱:NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有三種不同質量比的氧化銅與炭粉的混合物樣品①、②、③.甲、乙、丙三同學各取一種樣品,加強熱充分反應,測定各樣品中氧化銅的量.
(1)甲取樣品①強熱,若所得固體為金屬銅,將其置于足量的稀硝酸中微熱,產生1.12L氣體(標準狀況),則樣品①中氧化銅的質量為g.
(2)乙取樣品②ag強熱,生成的氣體不能使澄清的石灰水變渾濁.再將反應后的固體與足量的稀硝酸微熱,充分反應后,有bg固體剩余,該剩余固體的化學式為 . 樣品②中氧化銅質量為g (以含a、b的代數式表示).
(3)丙稱量樣品③強熱后剩余的固體,質量比原樣品減小了cg,若該固體為金屬銅,則樣品③中氧化銅物質的量(n)的取值范圍為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完全燃燒2mol某有機物,生成4molCO2和6molH2O,同時消耗5molO2,該有機物的分子式為
A. C2H6O2 B. C2H4O
C. C2H6O D. C2H6
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com