
| A. | 負極的反應式為:Zn2+-2e-=Zn | |
| B. | 正極反應式為2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 該電池放電過程中電解質溶液濃度不變 | |
| D. | 電池工作時OH-向負極遷移 |
分析 某電池以K2FeO4和Zn為電極材料,KOH溶液為電解溶質溶液,原電池發生工作時,Zn被氧化,為原電池的負極,K2FeO4具有氧化性,為正極,堿性條件下被還原生成Fe(OH)3,結合電極方程式以及離子的定向移動解答該題.
解答 解:A.負極發生氧化反應,電極反應式為:Zn-2e-=Zn2+,故A錯誤;
B.KOH溶液為電解質溶液,則正極電極方程式為2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-,故B錯誤;
C.該電池放電過程中電解質溶液濃度減小,故錯誤;
D.電池工作時陰離子OH-向負極遷移,故D正確.
故選D.
點評 本題考查原電池知識,為2016年海南高考題,側重考查學生的分析能力,題目較為基礎,注意從元素化合價的角度分析,把握原電池與氧化還原反應的關系,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用滴管滴加液體時,為防止液體滴到試管外面,滴管應緊貼管內壁 | |
| B. | 量筒里裝一定量水,沿時筒內壁緩緩倒入濃硫酸,邊倒邊攪拌,配制稀硫酸 | |
| C. | 皮膚上不慎沾灑上了濃硫酸,應先用水沖洗,再涂上一層氫氧化鈉溶液 | |
| D. | 稱量易潮解的藥品時藥品應放在小燒杯等容器中稱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳酸鈣難溶于水,放入水中,液體也不導電,所以碳酸鈣是非電解質 | |
| B. | 硫酸鋇在水中溶解度很小,所以它是弱電解質 | |
| C. | 向1mol•L-1的MgCl2溶液中加入等體積的2mol•L-1 NaOH 溶液后,液體中c(Mg2+)為0 | |
| D. | 向氯化鈣的濃溶液中加入濃燒堿溶液,溶液會變渾濁 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. .該分子的所有碳原子能否在一個平面上(填“能”或“不能”)不能.
.該分子的所有碳原子能否在一個平面上(填“能”或“不能”)不能.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、Cu2+、NO3-、SO42- | B. | K+、Na+、Cl-、ClO- | ||
| C. | Zn2+、NH4+、NO3-、Cl- | D. | K+、Na+、Ca2+、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 +3Br2→
+3Br2→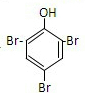 +3HBr
+3HBr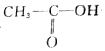 +H-O-CH2CH3$?_{△}^{濃H_{2}SO_{4}}$CH3COOCH2CH3+H2O
+H-O-CH2CH3$?_{△}^{濃H_{2}SO_{4}}$CH3COOCH2CH3+H2O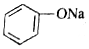 +CO2+H2O→C6H5OH+NaHCO3.
+CO2+H2O→C6H5OH+NaHCO3.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com