
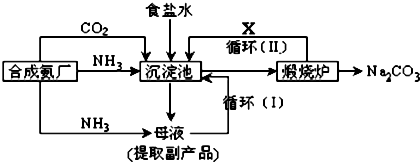
分析 (1)飽和食鹽水中通入氨氣和二氧化碳析出碳酸氫鈉晶體
(2)檢驗(yàn)產(chǎn)品碳酸鈉中是否含有氯化鈉即檢驗(yàn)是否含氯離子,可以用硝酸酸化的硝酸銀;
(3)循環(huán)Ⅱ是利用碳酸氫鈉分解生成的二氧化碳通入沉淀池循環(huán)使用.
解答 解:(1)氨氣、二氧化碳、水和氯化鈉發(fā)生反應(yīng)生成碳酸氫鈉和氯化銨,反應(yīng)方程式為NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,
故答案為:NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓;
(5)檢驗(yàn)產(chǎn)品碳酸鈉中是否含有氯化鈉即檢驗(yàn)是否含氯離子,可以用硝酸酸化的硝酸銀,觀察到若產(chǎn)生白色沉淀則說明有氯化鈉存在,若不生成沉淀,則無氯化鈉;
故答案為:用硝酸酸化的硝酸銀,觀察到若產(chǎn)生白色沉淀則說明有氯化鈉存在,若不生成沉淀,則無氯化鈉;
(3)循環(huán)Ⅰ是將未反應(yīng)的氯化鈉返回沉淀池中,煅燒碳酸氫鈉時(shí)生成二氧化碳、二氧化碳能循環(huán)利用,所以X是CO2,
故答案為:CO2.
點(diǎn)評 本題主要考查了實(shí)驗(yàn)方案的設(shè)計(jì),明確物質(zhì)的性質(zhì)是解本題關(guān)鍵,了解制備原理,知道常見物質(zhì)分離的方法,難度中等.



| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:選擇題
 25℃時(shí),已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲線如圖所示,下列說法錯(cuò)誤的是( )
25℃時(shí),已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲線如圖所示,下列說法錯(cuò)誤的是( )| A. | Ag2CO3的Ksp為8.1×10-12 | |
| B. | Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)平衡常數(shù)K=2.5×108 | |
| C. | 在Ag2CO3的飽和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y點(diǎn)到Z點(diǎn)) | |
| D. | 在0.001mol•L-1AgNO3溶液中滴入同濃度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
| 物質(zhì) | CH3OH | CH3OCH3 | H2O |
| c/mol•L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
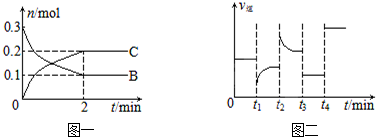
| A. | t2時(shí)改變的條件可能是增大c(C),平衡時(shí)B的物質(zhì)的量分?jǐn)?shù)增大 | |
| B. | t1時(shí)改變的條件是降溫,平衡逆向移動(dòng) | |
| C. | t3時(shí)可能是減小壓強(qiáng),平衡不移動(dòng);t4時(shí)可能是使用催化劑,c(B)不變 | |
| D. | x=2,反應(yīng)開始2 min內(nèi),v(B)=0.1 mol/(L•min) |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 若溫度不變將容器的容積增大1倍,達(dá)到新平衡時(shí)A的濃度變?yōu)樵瓉淼?.45 倍,則m+n>p+q | |
| B. | 若平衡時(shí),A、B的轉(zhuǎn)化率相等,說明反應(yīng)開始時(shí),A、B的物質(zhì)的量之比為m:n | |
| C. | 若升高平衡體系的溫度,達(dá)到新平衡時(shí)A 的濃度變?yōu)樵瓉淼?.55 倍,說明該反應(yīng)△H<0 | |
| D. | 若平衡后同時(shí)增大A、B的濃度,則A、B的轉(zhuǎn)化率一定都減小 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
 “潔凈煤技術(shù)”研究在世界上相當(dāng)普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續(xù)產(chǎn)出了熱值高達(dá)122500~16000kJ•m-3的煤炭氣,其主要成分是CO和H2.CO和H2可作為能源和化工原料,應(yīng)用十分廣泛.
“潔凈煤技術(shù)”研究在世界上相當(dāng)普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續(xù)產(chǎn)出了熱值高達(dá)122500~16000kJ•m-3的煤炭氣,其主要成分是CO和H2.CO和H2可作為能源和化工原料,應(yīng)用十分廣泛.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 通入22.4LSO2參加反應(yīng)時(shí),有2 NA個(gè)電子發(fā)生轉(zhuǎn)移 | |
| B. | 上述實(shí)驗(yàn)條件下,物質(zhì)的氧化性:Cu2+>I2>SO2 | |
| C. | 滴加KI溶液時(shí),KI被氧化,CuI是氧化產(chǎn)物 | |
| D. | 通入SO2后溶液逐漸變成無色,體現(xiàn)了SO2的漂白性 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com