
(15分)實驗室制乙烯時,產生的氣體能使Br2 的四氯化碳溶液褪色,甲、乙同學用下列實驗驗證。(氣密性已檢驗,部分夾持裝置略)。
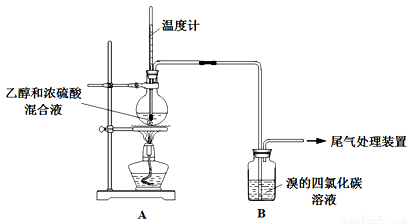
實驗操作和現象:
操 作 | 現 象 |
點燃酒精燈,加熱至170℃ | Ⅰ:A中燒瓶內液體漸漸變黑 Ⅱ:B內氣泡連續冒出,溶液逐漸褪色 |
…… | |
實驗完畢,清洗燒瓶 | Ⅲ:A中燒瓶內附著少量黑色顆粒狀物,有刺激性氣味逸出 |
(1)燒瓶內產生乙烯的化學方程式是 。
(2)溶液“漸漸變黑”,說明濃硫酸具有 性。
(3)分析使B中溶液褪色的物質,甲認為是C2H4,乙認為不能排除SO2的作用。
①根據甲的觀點,使B中溶液褪色反應的化學方程式是 。
②乙根據現象Ⅲ認為產生了SO2,在B中與SO2 反應使溶液褪色的物質是 。
③為證實各自觀點,甲、乙重新實驗,設計與現象如下:
設 計 | 現 象 | |
甲 | 在A、B間增加一個裝有某種試劑的洗氣瓶 | Br2的CCl4溶液褪色 |
乙 | 與A連接的裝置如下:
| D中溶液由紅棕色變為淺紅棕色時,E中溶液褪色 |
a.根據甲的設計,洗氣瓶中盛放的試劑是 。
b.根據乙的設計,C中盛放的試劑是 。
c.能說明確實是SO2使E中溶液褪色的實驗是 。
d.乙為進一步驗證其觀點,取少量D中溶液,加入幾滴BaCl2溶液,振蕩,產生大量白色沉淀,淺紅棕色消失,發生反應的離子方程式是 。
(4)上述實驗得到的結論是 。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016屆河南省濮陽市心高三上第一次市統摸底化學試卷(解析版) 題型:選擇題
下列表示對應反應的離子方程式正確的是
A.向稀 HNO3 中滴加 Na2SO3 溶液:SO32-+2H+=== SO2↑+H2O
B.雙氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+2H+=I2+ 2H2O
C.向 Al2(SO4)3 溶液中加入過量 NH3•H2O:Al3++4NH3•H2O === AlO2-+ 4NH4+ + 2H2O
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北大名縣第一中學高二上學期第一次月考試化學試卷(解析版) 題型:選擇題
下列敘述正確的是
A.在原電池的負極和電解池的陰極上都發生失電子的氧化反應
B.用惰性電極電解Na2SO4溶液,陰陽兩極產物的物質的量之比為1∶2
C.用惰性電極電解飽和NaCl溶液,若有1 mol電子轉移,則生成1 mol NaOH
D.鍍層破損后,鍍錫鐵板比鍍鋅鐵板更耐腐蝕
查看答案和解析>>
科目:高中化學 來源:2016屆云南省高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下列各項操作中,不發生“先產生沉淀,然后沉淀又溶解”現象的是
①向飽和碳酸鈉溶液中通入過量的CO2;
②向NaAlO2溶液中逐滴加入過量的稀鹽酸;
③向AlCl3溶液中逐滴加入過量的稀氫氧化鈉溶液;
④向硅酸鈉溶液中逐滴加入過量的鹽酸
A.①② B.①③ C.①④ D.②③
查看答案和解析>>
科目:高中化學 來源:2016屆山東省齊魯教科研協作體19所高三上學期第一次聯考化學試卷(解析版) 題型:選擇題
2015年4月,于敏獲頒“影響世界華人終身成就獎”。“钚--239”是“于敏型”氫彈的重要原料。下列說法正確的是
A.239Pu原子的原子核中含有239個質子
B.238Pu、239Pu和241Pu屬于不同的核素
C.238Pu與238U在元素周期表中的位置相同
D.239Pu衰變成235U屬于化學變化
查看答案和解析>>
科目:高中化學 來源:2016屆甘肅省張掖市高三上學期第一次質量檢測化學試卷(解析版) 題型:填空題
硫和氮氧化物是形成酸雨、霧霾等環境污染的罪魁禍首,采用合適的措施消除其污染是保護環境的重要舉措。
(1)研究發現利用NH3可消除硝酸尾氣中的NO污染。NH3與NO的物質的量之比分別為1﹕3、3﹕1、4﹕1時,NO脫除率隨溫度變化的曲線如圖所示:
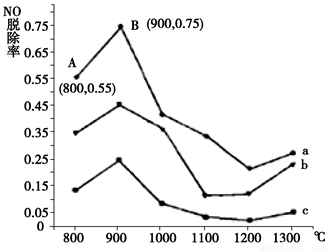
①用化學反應方程式表示NH3消除NO的反應原理 (不用注明反應條件)。
②曲線b 對應NH3與NO的物質的量之比是 。
③曲線a中,NO的起始濃度為6×10-4mg/m3,從A點到B點經過0.8 s,該時間段內NO的脫除速率為____ mg/(m3·s)。
(2)NO、NO2混合氣體能被NaOH溶液吸收生成NaNO2和NaNO3,若吸收的溶液中N 的濃度為ag·L- 1,要使1m3該溶液中的完全轉化為,至少需通入標準狀況下的O2 L。(用含a的代數式表示,計算結果保留整數)
(3)SO2被少許NaOH溶液吸收生成能使pH試紙變紅的NaHSO3溶液,工業上可電解NaHSO3得到重要化工產品Na2S2O4。
①NaHSO3溶液中離子濃度大小為 。
②寫出生成S2的電極反應式 。
查看答案和解析>>
科目:高中化學 來源:2016屆安徽省江南十校新高三摸底聯考化學試卷(解析版) 題型:選擇題
X,Y,Z,W為四種短周期主族元素,其中X,Z同族,Y,Z同周期,W是短周期主族元素中原子半徑最大的,X原子最外層電子數是核外電子層數的3倍,Y的最高正價與最低負價代數和為6,下列說法正確的是
A.Y,Z元素最高價氧化物對應的水化物酸性較強的為H2 Z04
B.離子半徑由大到小的順序為:W>Z>Y
C.X,Z兩種元素的氣態氫化物中,X的氣態氫化物較穩定,因為X的氫化物分子間有氫鍵
D.X與W形成的兩種化合物中,陰、陽離子物質的量之比均為1:2
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河南省高二開學考試化學試卷(解析版) 題型:填空題
(10分)(1)在一個固定體積為2升的密閉容器中,充入2molA和1molB,發生如下反應:2A(g)+B(g) 3C(g)+D(s),2分鐘反應達到平衡,此時C的濃度為1.2 mol/L。
3C(g)+D(s),2分鐘反應達到平衡,此時C的濃度為1.2 mol/L。
①2分鐘內用B表示的平均反應速度為 ;
②若容器溫度升高,平衡時混合氣體的平均摩爾質量減小,則正反應為 (填“吸熱”或“放熱”)反應。
(2)一定溫度下,在一定容積的密閉容器中發生如下可逆反應:
2A(g)+B(g) 2C(g)
2C(g)
在反應過程中,C的物質的量n(C)隨時間的變化關系如下圖所示(從t1時間開始對反應體系升高溫度)。
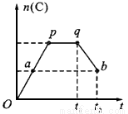
試回答下列問題:
①A點時,反應的v(正)v(逆)(填“>”、“<”或“=”);
②此反應的逆反應為 熱反應(填“放”或“吸”);
③A、B兩點的正反應速率:v(A)v(B)(填“>”、“<” 或“=”)。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年山西太原五中高二上第一周考理科化學試卷(解析版) 題型:選擇題
反應4NH3(g)+5O2(g) 4NO(g)+6H2O(g),在10L密閉容器中進行,半分鐘后,水蒸氣的物質的量增加了0.45mol,則此反應的平均速率V(x)可表示為
A.V(NH3)=0.010mol/(L·S) B.V(O2)=0.0010mol/(L·S)
C.V(NO)=0.0010mol/(L·S) D.V(H2O)=0.045mol/(L·S)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com