
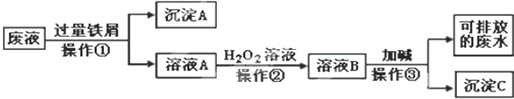
分析 Fe3+、Cu2+和過量的鐵反應生成Fe2+和單質Cu,通過過濾得到固體A和溶液A,由于鐵過量,沉淀A為Fe和Cu的混合物,溶液A含亞Fe2+;Fe2+具有還原性,易被氧化劑氧化,故加入H2O2能把Fe2+氧化成Fe3+,故溶液B中含Fe3+;Fe3+和氨水反應生成Fe(OH)3沉淀,故沉淀C為Fe(OH)3沉淀,廢水通過處理不含Fe3+、Cu2+,可以排放.
(1)操作①加入的過量的鐵屑,由于鐵的化學性質比銅活潑,因此可以把金屬銅從鹽溶液中置換出來,同時Fe3+能氧化單質鐵生成Fe2+,因此在第①得到的濾渣中都含有金屬銅過量的鐵;
(2)操作①中鐵分別與鐵離子、銅離子發生氧化還原反應,據此寫出反應的離子方程式;
(3)根據濾液中Fe2+能被過氧化氫生成Fe3+,加入雙氧水后的溶液中含有的金屬陽離子為Fe3+,加入強堿溶液后生成紅褐色氫氧化鐵沉淀,寫出方程式.
解答 解:(1)廢液中含有Fe3+、Cu2+兩種金屬離子,加入過量的鐵粉后,銅離子被還原成金屬銅,所以在第①得到的沉淀中含有金屬銅和過量的鐵,
故答案為:銅、鐵;
(2)操作①中,鐵與銅離子、鐵離子發生反應,反應的離子方程式為:
Fe+Cu2+=Fe2++Cu,Fe+2Fe3+=3Fe2+,
故答案為:Fe+Cu2+=Fe2++Cu;Fe+2Fe3+=3Fe2+;
(3)濾液中含有亞鐵離子,加入雙氧水后溶液中亞鐵離子氧化成鐵離子,鐵離子與氫氧根離子反應生成紅褐色氫氧化鐵沉淀,反應的離子方程式為FeCl3+3NaOH=Fe(OH)3↓+3NaCl,
故答案為:有紅褐色沉淀生成、FeCl3+3NaOH=Fe(OH)3↓+3NaCl.
點評 本題考查了金屬的回收與環境保護,題目難度中等,注意掌握金屬回收方法、常見的離子之間的反應,明確離子方程式的書寫方法,試題培養了學生的分析、理解能力及靈活應用所學知識的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氫氣的摩爾質量為1g•mol-1 | B. | 水的摩爾質量是18g | ||
| C. | 1molN2的質量為28g•mol-1 | D. | NO3-的摩爾質量是62g•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:計算題
| 加硫酸的次數序號 | 加入硫酸的體積/mL | 剩余固體的質量/g |
| 1 | 20.0 | 7.20 |
| 2 | 20.0 | 4.40 |
| 3 | 20.0 | 2.00 |
| 4 | 20.0 | 2.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com