【答案】
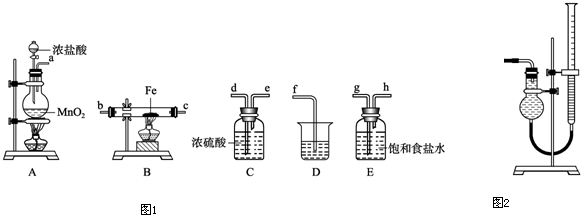
分析:(1)由裝置圖及藥品可知,利用氯氣與鐵反應制取氯化鐵.A中制取氯氣,二氧化錳與濃鹽酸反應生成氯化錳、氯氣、水;
(2)制備氯氣中含有氯化氫和水蒸氣,除去氯化氫氣體用飽和食鹽水,除去水蒸氣用濃硫酸,應先除氯化氫,后干燥,最后吸收尾氣中未反應的氯氣,防止污染空氣;
(3)氯氣中含水會導致生成的氯化鐵發(fā)生水解,得不到純凈的氯化鐵;D是吸收多余的氯氣防止污染空氣;
(4)B中硬質玻璃管內氯氣與鐵反應生成氯化鐵.用KSCN溶液檢驗Fe
3+,滴加KSCN溶液,溶液變成血紅色,說明含有Fe
3+;
(5)①根據滴定管的結構判斷;
②Cl
2能溶于水而難溶于飽和食鹽水,故應用飽和食鹽水,從而提高測量的準確性;
讀數時應使圓底燒瓶內外氣壓相等,故讀數前應使左右兩邊液面相平;
③滴定管內測量前后溶液體積變化為氣體體積,俯視時,讀取的液面的數值比實際偏小.
解答:解:(1)A中制取氯氣,二氧化錳與濃鹽酸反應生成氯化錳、氯氣、水,反應方程式為4HCl(濃)+MnO
2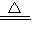
MnCl
2+Cl
2↑+2H
2O,
故答案為:4HCl(濃)+MnO
2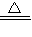
MnCl
2+Cl
2↑+2H
2O;
(2)制備氯氣中含有氯化氫和水蒸氣,除去氯化氫氣體用飽和食鹽水,除去水蒸氣用濃硫酸,應先除氯化氫,后干燥,最后吸收尾氣中未反應的氯氣,防止污染空氣,所以裝置順序為A→E→C→B→D,故答案為:E;C;B.
(3)如果進入B的氣體不干燥,FeCl
3容易水解,裝置C的作用是干燥Cl
2,防止FeCl
3的水解.D中反應是利用氫氧化鈉溶液吸收多余的氯氣,反應的離子方程式為:Cl
2+2OH
-=Cl
-+ClO
-+H
2O,故答案為:干燥Cl
2防止FeCl
3的水解;Cl
2+2OH
-=Cl
-+ClO
-+H
2O;
(4)B中硬質玻璃管內氯氣與鐵反應生成氯化鐵,B中因生成有FeCl
3而出現棕(紅)色的煙;用KSCN溶液檢驗Fe
3+,滴加KSCN溶液,溶液變成血紅色,說明含有Fe
3+,
故答案為:棕(紅)色的煙;硫氰酸鉀;
(5)①酸式滴定管下端由活塞,裝置中的滴定管沒有活塞,應是堿式滴定管,故答案為:堿式;
②Cl
2能溶于水而難溶于飽和食鹽水,故應用飽和食鹽水,從而提高測量的準確性.應使圓底燒瓶內外氣壓相等,讀數前應上下移動滴定管,使左右兩邊液面相平,
故答案為:飽和食鹽水;上下移動滴定管,使左右兩邊液面相平;
③俯視時,讀取的液面的數值比實際偏小,滴定管內測量前后溶液體積變化偏大,導致所測氣體的體積偏大,故答案為:偏大.
點評:本題有一定的綜合性,把氯氣的實驗室制法和氯氣的化學性質結合起來.考查學生對實驗原理、實驗裝置的理解、物質的制備與性質,難度中等,(5)③為易錯點,注意滴定管內測量前后溶液體積變化為氣體體積,滴定管數值由上而下增大.


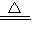 MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,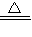 MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;

 舉一反三單元同步過關卷系列答案
舉一反三單元同步過關卷系列答案