
 鎳(Ni)是一種重要的金屬,金屬鎳及其化合物在合金材料以及催化劑等方面應用廣泛.
鎳(Ni)是一種重要的金屬,金屬鎳及其化合物在合金材料以及催化劑等方面應用廣泛.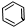 、④HCHO其中碳原子采取sp2雜化的分子有①③④(填物質序號),HCHO分子的立體結構為平面三角形;
、④HCHO其中碳原子采取sp2雜化的分子有①③④(填物質序號),HCHO分子的立體結構為平面三角形;分析 (1)Ni是28號元素,根據能量最低原則、泡利不相容原理和洪特規則,寫出其核外電子排布式為:1s22s22p43s23p43d84s2,據此判斷其外圍電子排布式;
(2)根據碳原子含有的σ鍵和孤電子對判斷碳原子采取的雜化方式; 根據價層電子對互斥理論判斷甲醛的空間構型;
(3)離子晶體的熔點與離子鍵的強弱有關,離子所帶電荷數越多,離子半徑越小,離子鍵越強,熔點越高;
(4)因為Ni0、Fe0的晶體結構類型均與氯化鈉的相同,而氯化鈉中陰陽離子的配位數均為6,所以Ni0晶胞中Ni和O的配位數也均為6;
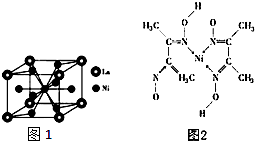
(5)晶胞中鑭原子數8×$\frac{1}{8}$=1;鎳原子數=1+8×$\frac{1}{2}$=5,由此可判斷出化學式;
(6)碳氮之間是雙鍵,雙鍵是由一個σ鍵和一個π鍵構成;鎳原子有空軌道,氮原子有孤電子對,因此二者形成配位鍵;丁二酮肟中甲基中的碳原子都是單鍵,在與氮相連的碳上有碳氮雙鍵,據此判斷雜化方式.
解答 解:(1)Ni是28號元素,其核外電子排布式為:1s22s22p43s23p43d84s2,價電子數為10,價電子排布式為3d84s2,
故答案為:3d84s2;
(2)①CH2=CH2中每個碳原子含有3個σ鍵,不含孤電子對,所以采取sp2雜化;
②HC≡CH中每個碳原子含有2個σ鍵,不含孤電子對,所以采取sp雜化;
③ 中每個碳原子含有3個σ鍵,不含孤電子對,所以采取sp2雜化;
中每個碳原子含有3個σ鍵,不含孤電子對,所以采取sp2雜化;
④HCHO中碳原子含有3個σ鍵,不含孤電子對,所以采取sp2雜化;
故碳原子采取sp2雜化的分子有①③④;
HCHO中碳原子含有3個σ鍵,不含孤電子對,所以其空間構型是平面三角形;
故答案為:①③④; 平面三角;
(3)Ni0、Fe0的晶體結構類型均與氯化鈉的相同,說明二者都是離子晶體,離子晶體的熔點與離子鍵的強弱有關,離子所帶電荷數越多,離子半徑越小,離子鍵越強,熔點越高.由于Ni2+的離子半徑小于Fe2+的離子半徑,屬于熔點是NiO>FeO,
故答案為:>;
(4)因為Ni0、Fe0的晶體結構類型均與氯化鈉的相同,而氯化鈉中陰陽離子的配位數均為6,所以Ni0晶胞中Ni和O的配位數也均為6.故答案為:6;6;
(5)晶胞中鑭原子數8×$\frac{1}{8}$=1;鎳原子數=1+8×$\frac{1}{2}$=5,所以化學式為LaNi5,故答案為:LaNi5;
(6)①碳氮之間是雙鍵,雙鍵是由一個σ鍵和一個π鍵構成;鎳原子有空軌道,氮原子有孤電子對,因此二者形成配位鍵;
②氧原子與氫原子之間可以形成氫鍵;
③丁二酮肟中甲基中的碳原子都是單鍵,在與氮相連的碳上有碳氮雙鍵,因此雜化類型是sp2和sp3雜化,
故答案為:①一個σ鍵、一個π鍵;配位鍵;②氫鍵;③sp2、sp3.
點評 本題考查晶體的結構與物質的性質的相互關系及應用,做題時注意電子排布式的書寫方法,晶體熔點比較發放,分子空間構型的判斷方法以及晶胞的有關計算,注意學習中有關做題方法的積累.


 輕松課堂單元測試AB卷系列答案
輕松課堂單元測試AB卷系列答案 小題狂做系列答案
小題狂做系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 將0.1mol的鎂、鋁混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.請回答:
將0.1mol的鎂、鋁混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 96倍 | B. | 48倍 | C. | 12倍 | D. | 32倍 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
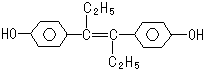
| A. | 遇FeCl3溶液顯紫色,因為該物質與苯酚屬于同系物 | |
| B. | 1mol該有機物可以與5mol Br2發生反應 | |
| C. | 可分別與NaOH和NaHCO3發生反應 | |
| D. | 該有機物分子中,所有原子可能共平面 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,X分子的空間構型為三角錐形.
,X分子的空間構型為三角錐形.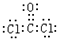 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
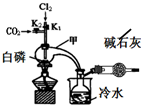 三氯化磷(PCl3)是合成藥物的重要化工原料,可通過白磷和氯氣化合得到.
三氯化磷(PCl3)是合成藥物的重要化工原料,可通過白磷和氯氣化合得到.| 物質 | 熔點/℃ | 沸點/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某同學通過如下實驗,探究化學反應中的能量變化.
某同學通過如下實驗,探究化學反應中的能量變化. ,用濕潤的紅色石蕊試紙檢驗該氣體.
,用濕潤的紅色石蕊試紙檢驗該氣體.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com