
【題目】25℃時,0.1mol Na2CO3與鹽酸混合所得溶液的體積為1L,溶液中部分微粒濃度與pH 的關系如圖所示。下列有關敘述正確的是

A. 隨溶液pH增大,c(CO32-)/c(HCO3-)的值先減小后增大
B. 25℃時,碳酸的第一步電離常數(shù)Ka1=10-6
C. pH=4 的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)=0.1mol/L
D. b點所示的溶液中:c(Na+)+c(H+)= 2c(CO32-)+c(OH-)+c(Cl-)
【答案】B
【解析】A. 氫氧根離子能與碳酸氫根離子反應,隨溶液pH增大,c(CO32-)/c(HCO3-)的值一直增大,選項A錯誤;B、25℃時,根據(jù)圖中信息,當pH=6時,c(H2CO3)= c(HCO3-),碳酸的第一步電離常數(shù)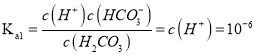 ,選項B正確;C、pH=4,說明反應中有CO2生成,所以根據(jù)物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 molL-1,選項C錯誤;:D、根據(jù)電荷守恒可知,溶液中離子應該滿足關系式c(Na+)+c(H+)=2 c(CO32-)+c(OH-)+c(Cl-)+c(HCO3-),選項D錯誤;答案選B。
,選項B正確;C、pH=4,說明反應中有CO2生成,所以根據(jù)物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 molL-1,選項C錯誤;:D、根據(jù)電荷守恒可知,溶液中離子應該滿足關系式c(Na+)+c(H+)=2 c(CO32-)+c(OH-)+c(Cl-)+c(HCO3-),選項D錯誤;答案選B。


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案科目:高中化學 來源: 題型:
【題目】如表是A、B、C、D、E五種有機物的有關信息:
A | ①能使溴的四氯化碳溶液褪色 ②比例模型為 ③能與水在一定條件下反應生成C |
B | ①由C、H兩種元素組成 ②球棍模型為 |
C | ①由C、H、O三種元素組成 ②能與Na反應 ③與E反應生成相對分子質量為88的酯 |
D | ①相對分子質量比C少2 ②能由C催化氧化得到 |
E | ①由C、H、O三種元素組成 ②其水溶液能使紫色石蕊溶液變紅 ③可由C發(fā)生氧化反應得到 |
回答下列問題:
(1)A~E中,屬于烴的是________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,發(fā)生反應的化學方程式為_______。
(3)C催化氧化生成D的化學方程式為_____________________。
(4)有機物B具有的性質是________(填序號)。
①無色無味的溶液;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)寫出B與溴在催化劑作用下發(fā)生反應的化學方程式為_______。
(6)寫出E與C反應生成相對分子質量為88的酯的化學方程式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在0.1mol·L-1CH3COOH溶液中存在如下電離平衡:CH3COOH![]() CH3COO-+H+對于該平衡,下列敘述正確的是 ( )
CH3COO-+H+對于該平衡,下列敘述正確的是 ( )
A. 加入水時,平衡向逆反應方向移動
B. 加入少量NaOH固體,平衡向正反應方向移動
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)減小
D. 加入少量CH3COONa固體,平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通常狀況下,下列物質中①硫酸鋇 ②醋酸 ③氯化氫 ④三氧化硫 ⑤氯氣 ⑥碳酸鈉 ⑦銅 ⑧硫酸溶液 ⑨氫氧化鉀 ⑩乙醇(下列各空填序號)
(1)屬于強電解質的是:________________。
(2)屬于弱電解質的是:________________。
(3)能導電的是:________________。
(4)屬于非電解質的是:________________。
(5)碳酸鈉溶液顯堿性的原因________(用離子方程式表達)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工業(yè)制硫酸的重要反應之一。
(1)將0.050 mol SO2和0.030 mol O2放入容積為1 L的密閉容器中,反應2SO2(g)+O2(g)![]() 2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol/L。
2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol/L。
①從平衡角度分析采用過量O2的目的是________________________;
②計算該條件下反應的平衡常數(shù)K=________________________。
③已知:K(300℃)>K(350℃),該反應是________熱反應。若反應溫度升高,SO2的轉化率________ (填“增大”、“減小”或“不變”)。
(2)某溫度下,SO2的平衡轉化率(![]() )與體系總壓強(P)的關系如圖1所示。平衡狀態(tài)由A變到B時,平衡常數(shù)K(A)_____K(B)(填“>”、“<”或“=”,下同)。
)與體系總壓強(P)的關系如圖1所示。平衡狀態(tài)由A變到B時,平衡常數(shù)K(A)_____K(B)(填“>”、“<”或“=”,下同)。
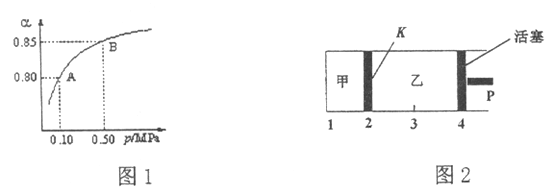
(3)如圖2所示,保持溫度不變,將2 mol SO2和1 mol O2加入甲容器中,將4 mol SO3加入乙容器中,隔板K不能移動。此時控制活塞P,使乙的容積為甲的2倍。
①若移動活塞P,使乙的容積和甲相等,達到新平衡時,SO3的體積分數(shù)甲______乙。
②若保持乙中壓強不變,向甲、乙容器中通入等質量的氦氣,達到新平衡時,SO3的體積分數(shù)甲_______乙。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學是一門以實驗為基礎的自然科學,用下列各裝置或其組合能完成相應實驗的是(已知實驗室可用塊狀硫化亞鐵(FeS)與稀硫酸反應制取硫化氫(H2S)氣體)

A. 裝置②⑦可用于制取并收集干燥的CO2
B. 裝置①⑤可用于制取并收集氧氣
C. 裝置②⑥可用于制取并收集硫化氫(H2S)氣體
D. 裝置④裝滿水后可以收集并儲存氧氣,需要氧氣時可用水將裝置中的氧氣排出,水應從b端通入
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面是以有機物A合成聚酯類高分子化合物F的路線:

已知:
回答下列問題:
(1)A生成B的反應類型為_____,C中的官能團名稱為________。
(2)D與NaOH水溶液反應的化學方程式為________。
(3)①E生成F的化學方程式為________。
②若F的平均相對分子質量為20000,則其平均聚合度為________。(填字母)
A.54 B.108 C.119 D.133
(4)E在一定條件下還可以合成含有六元環(huán)狀結構的G。G的結構簡式為________。
(5)滿足下列條件的C的同分異構體有_____種。(不考慮立體異構)
①含有1個六元碳環(huán)且環(huán)上相鄰4個碳原子上各連有一個取代基
②1mol該物質與斐林試劑反應產生2mol磚紅色沉淀
(6)寫出用![]() 為原料制各化合物
為原料制各化合物 的合成路線______。(其他試劑任選)
的合成路線______。(其他試劑任選)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】歸納總結是學習化學的一種方法。
(1)甲同學發(fā)現(xiàn)A、B、C三種物質有如圖l所示的相互反應關系,“—”表示能反應(部分反應物、生成物以及反應條件省略,下同)。

已知A是常見金屬,人體缺乏A元素易患貧血癥;B是胃酸的主要成分;B與C反應產生不溶于稀硝酸的白色沉淀,則A是____(填化學式,下同),C是_______。請寫出下列反應的化學方程式:A與B________________;B與C____________________。
(2)乙同學發(fā)現(xiàn)X、Y、Z三種物質有如圖2所示的循環(huán)轉化關系“→”表示能轉化。
①若X、Y、Z均為含鈣化合物,X是一種常用干燥劑,Y俗稱熟石灰。則X的化學式為______;請寫出Y→Z的反應化學方程式________________。
②若X是碳單質,Y、Z是含有碳元素的氧化物,X、Y、Z的相對分子質量依次增大,則Y的相對分子質量為___;Z→X可通過以下反應實現(xiàn):___________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G為7種短周期主族元素,其原子序數(shù)依次增大。A、C可形成A2C和A2C2兩種化合物,B的最高正化合價與最低負化合價的絕對值之差為2,D和A同主族,E是地殼中含量最高的金屬元素,F和C同主族且可形成FC2和FC3兩種化合物。
(1)G的元素名稱是__________,它在元素周期表中的位置是______________。
(2)F的質子數(shù)和中子數(shù)相等,F的原子組成符號為______,它的最高價為____價。
(3)C、D可形成一種淡黃色固體化合物,寫出此化合物的電子式__________。
(4)由上述7種元素中的4種元素組成的化合物X,X既能與熱的NaOH溶液反應,也能與稀鹽酸反應,且均能生成無色氣體,X的化學式是____________________。
(5)已知Se在第四周期,與S同主族,請任意寫出一種含Se物質的化學式,預測其性質,并說明預測依據(jù)_______。
含Se物質化學式 | 性質 | 預測依據(jù) |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com