
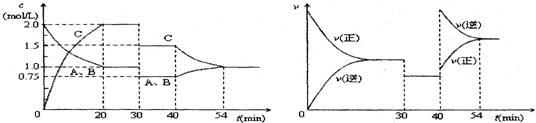
| A. | 30min時減小容積 | |
| B. | 40min時加入催化劑 | |
| C. | 0~20min內A的平均反應速率為0.05mol•L-1•min-1 | |
| D. | 正反應為吸熱反應 |
分析 從該題圖1可知,0-20min是反應:A(g)+B(g)?2C(g)達到平衡的過程,20min時各濃度保持不變,正逆反應速率相等,反應達到平衡狀態,20-30min,是保持平衡狀態過程;反應物和生成物的濃度都減少,結合右圖象知,30min改變條件,正逆反應速率相等且減小平衡不移動;40-54min,左圖知,反應物濃度增大生成物濃度減小,右圖知正逆反應速率都增大,且與原平衡點無接觸點,逆反應速率大于正反應速率,當正逆反應速率相等時,再次達到平衡狀態,據此分析回答計算選項.
解答 解:A、從右圖可知,30min時正反應速率和逆反應速率同時降低.30min時減小容積,壓強減小,平衡不動,物質濃度減小,但此時左圖中30-40min,A、B的濃度在減少,C的濃度在增加.故A錯誤;
B、催化劑值改變反應速率不改變化學平衡,40min由圖象可知,反應物濃度增大生成物濃度減小,右圖知正逆反應速率都增大,且與原平衡點無接觸點,逆反應速率大于正反應速率,當正逆反應速率相等時,再次達到平衡狀態,故B錯誤;
C.0-20min內,由左圖可知,A的變化濃度為1mol/L,平均反應速率=$\frac{1mol/L}{20min}$=0.05mol•L-1•min-1,故C正確;
D、當反應A(g)+B(g)?2C(g),反應前后氣體總的量不變.壓強改變,平衡不移動.右圖中30-40min,平衡不移動,此時左圖中30-40min,A、B的濃度在減少,C的濃度在增加.顯示平衡向正反應方向移動與壓強改變平衡不移動矛盾;正反應為吸熱反應,在其它條件不變時,升高反應溫度,有利于吸熱反應,平衡向吸熱反應方向移動,即平衡向正反應方向移動,升高反應溫度,反應速率加快與右圖中30-40min正反應速率和逆反應速率同時降低矛盾.故D錯誤.
故選:C.
點評 該題為化學平衡圖象題.解化學平衡圖象題,看圖象:一看軸,弄清橫坐標和縱坐標的意義.二看點,弄清圖象上點的意義,看起點,交點,轉折點,終點.三看量的變化,利用相關公式進行計算,明確外界條件對化學平衡的影響是解本題的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
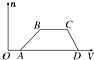 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的幾種物質,往該溶液中逐滴加入NaOH溶液,產生沉淀的物質的量(n)與加入的NaOH溶液體積(V)的關系如圖所示.回答下列問題.
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的幾種物質,往該溶液中逐滴加入NaOH溶液,產生沉淀的物質的量(n)與加入的NaOH溶液體積(V)的關系如圖所示.回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 制取
制取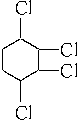 ,其合成流程如下:
,其合成流程如下: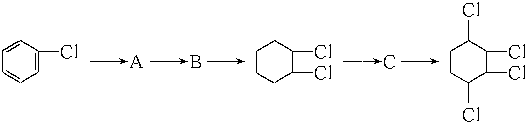
 這兩步反應的化學方程式.
這兩步反應的化學方程式.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用分液漏斗進行分液操作時,先打開分液漏斗旋塞,使下層液體慢慢流出,待下層液體完全流出后,關閉旋塞,再將上層液體從上口倒出 | |
| B. | 用鑷子夾取金屬鈉固體,切割取用后剩余的鈉放回原試劑瓶中 | |
| C. | 用標準濃度的鹽酸滴定未知濃度NaOH溶液時,酸式滴定管用蒸餾水洗凈后未用同濃度鹽酸潤洗,將導致測定結果偏低 | |
| D. | 溶液配制、中和滴定實驗中,容量瓶、錐形瓶用蒸餾水洗凈后即可使用;而滴定管、移液管用蒸餾水洗凈后,須再用待裝液潤洗2~3次后方可使用 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com