

 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑; 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;

 寒假學與練系列答案
寒假學與練系列答案科目:高中化學 來源: 題型:

| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2010-2011學年浙江省高三上學期第一次月考化學卷 題型:選擇題
已知下列物質都能氧化H2S,它們氧化H2S時自身分別發生下列變化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2→2Br-,HNO3→NO。如要氧化等物質的量的H2S氣體得到S單質,需要上述離子或物質的物質的量最小的是
A.Fe3+ B.Br2 C.Cr2O72- D.HNO3
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
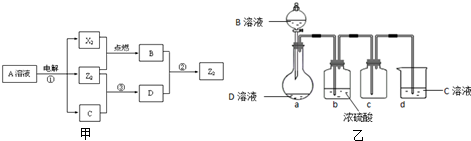
查看答案和解析>>
科目:高中化學 來源: 題型:
已知下列物質都能氧化H2S,它們氧化H2S時自身分別發生下列變化:Fe3+→Fe2+,Cr2O72-→2Cr3+,Br2→2Br-,HNO3→NO。如要氧化等物質的量的H2S氣體得到S單質,需要上述離子或物質的量最小的是( )
A.Fe3+ B.Br2 C.Cr2O72- D.HNO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com