
【題目】氮化鋁(AlN)陶瓷是一種新型無機非金屬材料,利用它較高的體積電阻率、絕緣強度大、導熱性能好,可用作大功率半導體器件的絕緣基片、大規模和超大規模集成電路的散熱基片和封裝基片。工業上可用氮氣和鋁在高溫下直接化合法來制備氮化鋁粉體(AlN粉體在潮濕的空氣中易發生水解反應)。已知:實驗室可用飽和亞硝酸鈉(NaNO2)溶液和氯化銨溶液共熱制取氮氣。現提供以下裝置來模擬工業制取AlN粉體。
(1)寫出實驗室制取氮氣的化學方程式:___________________________。
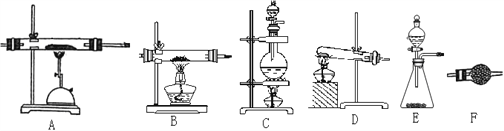
(2)請從下圖中選擇合適的裝置按順序組裝一套用氮氣和鋁粉制AlN的裝置(裝置可以根據需要重復使用):________________________________。
(3)實驗開始后應先給_______處裝置加熱一段時間再給另一處裝置加熱,這樣操作的原因是:_______________。
(4)已知:氮化鋁(AlN)既能溶于強酸,又能溶于強堿,試寫出AlN與HCl溶液反應的化學方程為________________。
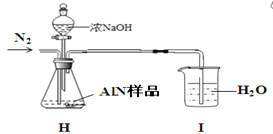
(5)AlN制備過程中存在一些副反應致生成的AlN不純。 研究小組的同學取2.0500 g AlN樣品與濃NaOH溶液充分反應,通過測定產生氨氣的量來測定AlN的純度(假設雜質與堿反應不生成NH3,忽略NH3在強堿性溶液中的溶解)。實驗裝置如下:請幫該同學糾正裝置中一處明顯錯誤:___________________。當H中反應完全后持續緩慢通入氮氣將生成的氨全部吹入I中被水吸收。然后將I中氨水_________________________________________________________________________(請補充完這步操作,需根據后面數據計算作答),用_______取25.00mL氨水于錐形瓶中并加入幾滴_______作指示劑,用0.1000mol/L的鹽酸滴定至終點,消耗鹽酸體積為22.50mL,經計算得AlN的純度為90.00 %。
【答案】 NaNO2+NH4Cl=N2↑+NaCl+2H2O CFAF C 通氮氣排盡裝置內空氣,防止氧氣干擾實驗 AlN+4HCl=AlCl3+NH4Cl 將I中導管改為連接一個倒扣漏斗吸收氨氣 轉移到500mL容量瓶中定容配成500mL溶液 堿式滴定管 甲基橙
【解析】 (1)由題意知,實驗室用飽和亞硝酸鈉(NaNO2)溶液和氯化銨溶液共熱制取氮氣,該反應的化學方程式為NaNO2+NH4Cl=N2↑+NaCl+2H2O。
(2)可以選擇C作為氮氣的發生裝置,選擇F作為氮氣的干燥裝置,選擇A作為氮化鋁的制備裝置,最后再加一個F,防止空氣中的水蒸氣進入A裝置,引起氮化鋁水解。所以,可以按CFAF順序組裝一套用氮氣和鋁粉制AlN的裝置。
(3)實驗開始后應先給C處裝置加熱一段時間再給另一處裝置加熱,這樣操作的原因是:通氮氣排盡裝置內空氣,防止氧氣干擾實驗。
(4)由于氮化鋁(AlN)既能溶于強酸,又能溶于強堿,所以AlN與HCl溶液反應可以生成兩種鹽,其化學方程為AlN+4HCl=AlCl3+NH4Cl。
(5) 該實驗裝置中的尾氣處理裝置設計不正確,容易引起倒吸,應將I中導管改為連接一個漏斗倒扣于燒杯水面吸收氨氣。當H中反應完全后持續緩慢通入氮氣將生成的氨全部吹入I中被水吸收。然后將I中氨水轉移到500mL容量瓶中定容配成500mL溶液,用堿式滴定管取25.00mL氨水于錐形瓶中并加入幾滴甲基橙作指示劑,用0.1000mol/L的鹽酸滴定至終點,消耗鹽酸體積為22.50mL,經計算得AlN的純度為90.00 %。


科目:高中化學 來源: 題型:
【題目】咖啡酸具有較廣泛的抑菌作用,結構簡式為![]() 。下列有關說法中正確的是
。下列有關說法中正確的是
A. 該物質可以發生水解反應
B. 可以用酸性高錳酸鉀溶液檢驗碳碳雙鍵
C. 1 mol咖啡酸與足量鈉、碳酸氫鈉溶液反應,在相同條件下生成氣體的體積比為1∶2
D. 1 mol咖啡酸可與4 mol Br2發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(2016·新課標全國卷Ⅰ)元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)4(綠色)、Cr2O72(橙紅色)、CrO42(黃色)等形式存在,Cr(OH)3為難溶于水的灰藍色固體,回答下列問題:
(1)Cr3+與Al3+的化學性質相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至過量,可觀察到的現象是_________。
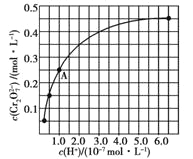
(2)CrO42和Cr2O72在溶液中可相互轉化。室溫下,初始濃度為1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)隨c(H+)的變化如圖所示。
L1的Na2CrO4溶液中c(Cr2O72)隨c(H+)的變化如圖所示。
①用離子方程式表示Na2CrO4溶液中的轉化反應____________。
②由圖可知,溶液酸性增大,CrO42的平衡轉化率__________(填“增大”“減小”或“不變”)。根據A點數據,計算出該轉化反應的平衡常數為__________。
③升高溫度,溶液中CrO42的平衡轉化率減小,則該反應的ΔH__0(填“大于”“小于”或“等于”)。
(3)在化學分析中采用K2CrO4為指示劑,以AgNO3標準溶液滴定溶液中Cl,利用Ag+與CrO42生成磚紅色沉淀,指示到達滴定終點。當溶液中Cl恰好沉淀完全(濃度等于1.0×105 mol·L1)時,溶液中c(Ag+)為_______ mol![]() L1,此時溶液中c(CrO42)等于__________ mol
L1,此時溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分別為2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分別為2.0×1012和2.0×1010)。
(4)+6價鉻的化合物毒性較大,常用NaHSO3將廢液中的Cr2O72還原成Cr3+,該反應的離子方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁熱反應的實驗裝置如圖。下列有關鋁熱反應的說法中,不正確的是
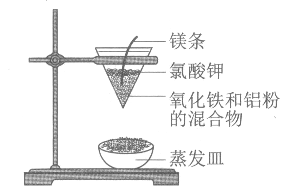
A. 鋁熱反應是放熱反應
B. 鋁熱反應可用于冶煉某些高熔點金屬
C. 實驗中鎂條的主要作用是還原氧化鐵
D. 實驗現象為火星四濺,漏斗下方有紅熱熔融物流出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列操作中,能使水的電離平衡向右移動且使液體呈酸性的是
A. 向水中加入NaHSO4 B. 向水中加入CuSO4
C. 向水中加入Na2CO3 D. 將水加熱到100℃,使pH=6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應中常伴隨著能量變化。將Al條打磨后,插入6 mol/L鹽酸中。
(1)Al與鹽酸反應的離子方程式是________。
(2)該反應的能量變化可用下圖中的________表示(填序號)。

(3)H2的產生速率隨時間的變化如圖所示。

t1~t2速率變化的主要原因是________。
t2~t3速率變化的主要原因是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,在下列溶液中可能大量共存的離子組是
A. pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B. 由水電離出的c(H+)=1×10-13 mol/L的溶液:Al3+、K+、SO42-、Cl-
C. c (OH-)/c(H+)=1012的溶液中:Na+、SO42-、NO3-、HCO3-
D. 滴加KSCN變紅色的溶液:Na+、K+、Al3+、CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E 都為短周期元素,A 原子失去一個電子后成為一個質子;C 的-1 價陰離子與氖原子具有相同的電子層結構;D在C 的下一周期,D可與同周期的B形成 BD2型離子化含物;E 和 C為同一周期元素,其最高價氧化物對應的水化物為一種強酸。請根據以上信息回答下列問題。
(1)B元素在元素周期表中的位置是____________。
(2)A與 E 形成的最簡單化合物的電子式為____________。
(3)C的氫化物與 D的氫化物的沸點相比較: ____________(用化學式表示,且用>符號連接)。 解釋原因______________。
(4)E 的氫化物與 E 的最高價氧化物對應水化物反應的生成物中含有的的化學鍵有____________。
(5)E 的最高價氧化物對應的水化物的稀溶液與過量鐵粉發生反應的離子方程式為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列配制的溶液濃度偏高的是( )
A.配制硫酸用量筒量取硫酸時俯視刻度線
B.配制鹽酸定容時,仰視容量瓶刻度線
C.NaOH溶解后未經冷卻即注入容量瓶至刻度線
D.稱量4gNaOH配制0.1mol/L NaOH溶液1000mL時,砝碼錯放左盤
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com