
【題目】NO、NO2是汽車尾氣中主要的含氮氧化物。回答下列問題:
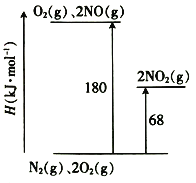
(1)已知氮氧化物轉化過程中的能量變化如圖(圖中表示生成2 mol NO2的能量變化)。1 mol NO氧化為NO2的焓變△H=___________。
(2)某溫度下,反應的平衡常數如下:
a.2NO2(g) ![]() N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) ![]() N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反應趨勢較大的反應是__________(填“a”或“b”);反應2NO(g)+O2(g) ![]() 2NO2(g)的K=_____________。
2NO2(g)的K=_____________。
(3)已知反應2NO(g)+O2(g) ![]() 2NO2的正反應速率v正=k1Cm(NO)cn(O2),其中k為速率常數,可通過下列實驗數據計算k、m、n。
2NO2的正反應速率v正=k1Cm(NO)cn(O2),其中k為速率常數,可通過下列實驗數據計算k、m、n。
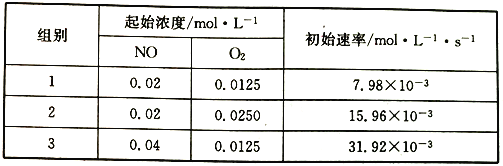
則k1=______________,m=______________,n=______________,
(4)已知該反應的歷程為:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2慢反應
2NO2慢反應
其中可近似認為第二步反應不影響第一步的平衡,第一步反應中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列敘述正確的是________(填字母)。
A.第一步反應的平衡常數K=![]()
B.v(第一步的正反應)<v(第二步的反應)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2與O2的碰撞100%有效
(5)一定條件下測得容器中NO、O2、NO2濃度發生如下變化。
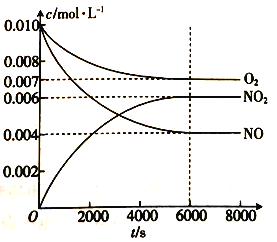
①NO的平衡轉化率為 _______________。
②該溫度下反應2NO(g)+O2(g)![]() 2NO2(g)的平衡常數為______________(保留整數)
2NO2(g)的平衡常數為______________(保留整數)
【答案】-56KJ·mol-1 b 3.28×1013 1596L2·mol-2·s-1 2 1 AC 60% 321
【解析】
(1)由圖結合蓋斯定律計算出生成1molNO2放出的熱量;
(2)平衡常數越大,反應越容易進行;
反應b-a得2NO(g)+O2(g) ![]() 2NO2(g),K=2.2×1030/6.7×1016;
2NO2(g),K=2.2×1030/6.7×1016;
(3)由組1和2,NO濃度不變時,氧氣的濃度增大1倍,速率也增大1倍,故n=1;
由組1和3,NO的濃度增大1倍,速率變為原來的4倍,故m=2;代入其中一組數據可求出k1;
(4)A、根據平衡常數的定義分析;
B、v(第一步的正反應)是快反應;
C、第二步的反應難,活化能高;
D、第二步中N2O2與O2的有效碰撞率小,反應難。
(5)①NO的平衡轉化率=NO的變化量/NO的投料量;
②該溫度下反應2NO(g)+O2(g)![]() 2NO2(g)的平衡常數為c2(NO2)/c2(NO)c(O2).
2NO2(g)的平衡常數為c2(NO2)/c2(NO)c(O2).
(1)圖中表示生成2 mol NO2的能量變化,①N2(g)+2O2(g) =2NO2(g) △H=68KJ·mol-1
②N2(g)+O2(g) =2NO(g) △H=180KJ·mol-1,由蓋斯定律,①-②得2NO(g) +O2(g) =2NO2(g) △H=-112KJ·mol-1,兩邊同除以2得:NO(g) +1/2 O2(g) =NO2(g) △H=-56KJ·mol-1;
(2)平衡常數越大,反應越容易進行,b.2NO(g) ![]() N2(g)+O2(g)平衡常數K=2.2×1030大,故選b;
N2(g)+O2(g)平衡常數K=2.2×1030大,故選b;
反應b-a得2NO(g)+O2(g) ![]() 2NO2(g),K=2.2×1030/6.7×1016=3.28×1013;
2NO2(g),K=2.2×1030/6.7×1016=3.28×1013;
(3)由組1和2,NO濃度不變時,氧氣的濃度增大1倍,速率也增大1倍,故n=1;
由組1和3,NO的濃度增大1倍,速率變為原來的4倍,故m=2;
將m和n代入第1組數據,7.98×10-3mol·L-1·s-1=k1×(0.02mol·L-1)2×0.0125mol·L-1,解得k1=1596L2·mol-2·s-1;
(4)A、第一步反應的平衡常數K=c(N2O2)/c2(NO),平衡時v(正)=v(逆)==k1c2(NO)=k-1c(N2O2),得c(N2O2)/c2(NO)=k1/k-1,K=c(N2O2)/c2(NO)==k1/k-1,故A正確;
B、v(第一步的正反應)是快反應,v(第二步的反應)是慢反應,v(第一步的正反應)>v(第二步的反應),故B錯誤;
C、第二步的反應難,活化能高,第二步的活化能比第一步的活化能高,故C正確;
D、第二步是慢反應,說明N2O2與O2的有效碰撞的幾率較小,不可能達到100%,故D錯誤。
故選AC。
(5)①NO的平衡轉化率=NO的變化量/NO的投料量=(0.010mol·L-1-0.004mol·L-1)/0.010mol·L-1=0.6;
該溫度下反應2NO(g)+O2(g)![]() 2NO2(g)的平衡常數為c2(NO2)/c2(NO)c(O2)=0.0062/0.0042×0.007=321.
2NO2(g)的平衡常數為c2(NO2)/c2(NO)c(O2)=0.0062/0.0042×0.007=321.


 暑假銜接培優教材浙江工商大學出版社系列答案
暑假銜接培優教材浙江工商大學出版社系列答案 欣語文化快樂暑假沈陽出版社系列答案
欣語文化快樂暑假沈陽出版社系列答案科目:高中化學 來源: 題型:
【題目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150ml 4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(標準狀況),往所得溶液中加入KSCN溶液,無血紅色出現。若用足量的H2在加熱條件下還原相同質量的混合物,所得到的鐵的物質的量為
A. 0.21 mol
B. 0.25 mol
C. 0.3 mol
D. 0.35 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,這三種溶液中硫酸根離子濃度之比是( )
A.1︰1︰1B.3︰2︰1C.3︰2︰3D.1︰1︰3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,在20.0mL0.10molL-1氨水中滴入0.10molL-1的鹽酸,溶液的pH與所加鹽酸的體積關系如圖所示。已知0.10molL-1氨水的電離度為1.32%,下列有關敘述不正確的是( )
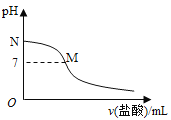
A. 該滴定過程應該選擇甲基橙作為指示劑
B. M點對應的鹽酸體積大于20.0mL
C. M點處的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D. N點處的溶液中pH小于12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種從廢鈷錳催化劑[含53.1%(CH3COO)2Co、13.2%(CH3COO)2Mn、23.8%CoCO3、6.5%Mn(OH)2、1.3%SO2及對二甲苯等有機物等]中回收鈷和錳的工藝流程如下:
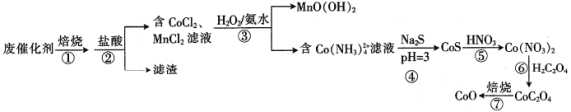
回答下列問題:
(1)步驟①焙燒的目的是_________________________________。
(2)步驟②酸浸時,控制鹽酸適當過量、溶液加熱并充分攪拌,其目的是___________。
(3)步驟③MnCl2與H2O2和氨水反應的離子方程式為______________________。
(4)步驟④調節pH時采用CH3COOH和CH3 COONa混合溶液,該混合溶液稱為緩沖溶液,該溶液中加入少量的酸、堿或稀釋時pH變化均不大,其中稀釋時pH變化不大的原因是______________________。
(5)步驟⑤硝酸溶解CoS生成Co(NO3)2同時生成NO和S,該反應的化學方程式為______________________。
(6)步驟⑦若在實驗室進行,所需的硅酸鹽質儀器除酒精燈和玻璃棒外,還有___________(填儀器名稱)。
(7)某工廠用mkg廢催化劑最終制得 CoO n kg,則CoO的產率為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲將0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求兩種溶液的體積比(忽略混合時體積變化)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用CO合成甲醇(CH3OH)的化學方程式為CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如下圖所示。下列說法正確的是( )。
CH3OH(g) ΔH<0,按照相同的物質的量投料,測得CO在不同溫度下的平衡轉化率與壓強的關系如下圖所示。下列說法正確的是( )。

A. 溫度:T1>T2>T3
B. 正反應速率:v(b)>v(d) v(a)>v(c)
C. 平衡常數:K(a)>K(c) K(b)=K(d)
D. 平均摩爾質量:M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碘化鈉在醫藥上用作祛痰劑和利尿劑,也用于治療甲狀腺腫病,生活中用作照相膠片感光劑,碘的助溶劑,也用于配制碘乳劑。某實驗小組用NaOH、單質碘和水合肼(N2H4·H2O)為原料制備碘化鈉。
回答下列問題:
(1)水合肼的制備原理為:NaClO+2NH3=N2H4·H2O+NaCl。
①用下圖裝置組裝制備水合肼,連接順序為_____→ → → → → (用字母表示).
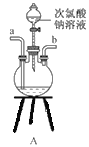
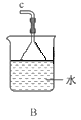
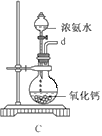
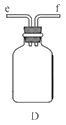
②裝置C中發生反應的化學方程式為________________,裝置D的作用是_______________。
(2)碘化鈉的制備步驟
向三頸燒瓶中加入8.2gNaOH及30mL水,攪拌冷卻,加入25.4g單質碘,開動磁力攪拌器,保持60-70℃至反應充分;繼續加入稍過量的N2H4·H2O(水合肼),還原NaIO和NaIO3,得NaI溶液粗品,同時釋放一種空氣中的某氣體;向上述反應液中加入1.0g活性炭,煮沸半小時,然后將溶液與活性炭分離;將分離出的溶液蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,得產品24.3g。
①反應溫度不宜超過70℃的原因是___________________ ,該步驟反應完全的現象是______________。
②IO-被還原的離子方程式為_______________________________。
③“將溶液與活性炭分離”的方法是____________。
④該實驗小組產率為________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com