
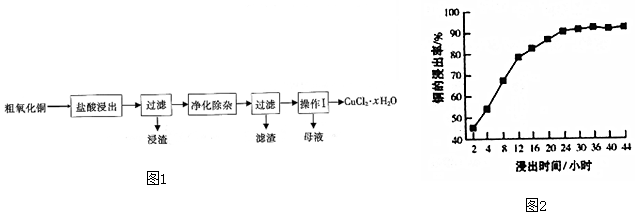
分析 粗氧化銅(含Fe2O3、FeO、Cu2O以及少量不溶性雜質)中加入稀鹽酸,已知“浸渣”中不含銅單質,說明CuO、Fe2O3、FeO、Cu2O和稀鹽酸反應后的溶液中含有CuCl2、FeCl2,Cu2O和稀鹽酸生成的Cu被鐵離子還原生成銅離子,“凈化除雜”需先加入ClO2,二氧化氯具有強氧化性,能氧化亞鐵離子生成鐵離子,然后再調節溶液的pH約為4,調節溶液pH值時要消耗氫離子且不能引進新的雜質,然后過濾得到濾渣氫氧化鐵,濾液中含有氯化銅,從濾液中通過蒸發濃縮、冷卻結晶、過濾得到CuCl2•xH2O,
(1)Cu2O在“鹽酸浸出”中和稀鹽酸、氧化鐵反應生成氯化銅、氯化亞鐵和水;
(2)根據反應時間與浸出率及曲線變化趨勢分析判斷;
(3)二氧化氯具有強氧化性,能氧化還原性離子;調節溶液pH值時加入的物質能和氫離子反應且不能引進新的雜質;
(4)從溶液中獲取晶體采用蒸發濃縮、冷卻結晶、過濾的方法;CuCl2•xH2O能溶于水不溶于乙醇,且乙醇易揮發;
(5)最終得到的固體是CuO,根據Cu原子守恒得關系式CuCl2•xH2O----CuO,根據關系式計算x值.
解答 解:粗氧化銅(含Fe2O3、FeO、Cu2O以及少量不溶性雜質)中加入稀鹽酸,已知“浸渣”中不含銅單質,說明CuO、Fe2O3、FeO、Cu2O和稀鹽酸反應后的溶液中含有CuCl2、FeCl2,Cu2O和稀鹽酸生成的Cu被鐵離子還原生成銅離子,“凈化除雜”需先加入ClO2,二氧化氯具有強氧化性,能氧化亞鐵離子生成鐵離子,然后再調節溶液的pH約為4,調節溶液pH值時要消耗氫離子且不能引進新的雜質,然后過濾得到濾渣氫氧化鐵,濾液中含有氯化銅,從濾液中通過蒸發濃縮、冷卻結晶、過濾得到CuCl2•xH2O,
(1)Cu2O在“鹽酸浸出”中和稀鹽酸、氧化鐵反應生成氯化銅、氯化亞鐵和水,反應方程式為Fe2O3+Cu2O+8HCl=2CuCl2+2FeCl2+4H2O,
故答案為:Fe2O3+Cu2O+8HCl=2CuCl2+2FeCl2+4H2O;
(2)根據圖象知,隨著浸出時間(0-2h)的增加,Cu的浸出率相應的增加;浸出時間超過2h后,Cu的浸出率變化不明顯,
故答案為:隨著浸出時間(0-2h)的增加,Cu的浸出率相應的增加;浸出時間超過2h后,Cu的浸出率變化不明顯;
(3)二氧化氯具有強氧化性,能氧化還原性離子亞鐵離子,離子方程式為5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O;調節溶液pH值時加入的物質能和氫離子反應且不能引進新的雜質,AD都引進雜質,只有BC能和氫離子反應且不引進雜質,
故答案為:5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O;BC;
(4)從溶液中獲取晶體采用蒸發濃縮、冷卻結晶、過濾的方法;CuCl2•xH2O能溶于水不溶于乙醇,且乙醇易揮發,所以用乙醇洗滌不用水洗滌,
故答案為:蒸發濃縮、冷卻結晶、過濾;防止CuCl2•xH2O溶解,且乙醇易揮發;
(5)最終得到的固體是CuO,根據Cu原子守恒得關系式CuCl2•xH2O----CuO,
CuCl2•xH2O----CuO
135+18x 80
ag bg
(135+18x):80=ag:bg
x=$\frac{80a-135b}{18b}$,
故答案為:$\frac{80a-135b}{18b}$.
點評 本題考查物質制備,為高頻考點,涉及方程式的計算、氧化還原反應、除雜、分離提純等知識點,明確流程圖中發生的反應及物質性質是解本題關鍵,注意:除雜時不能引進新的雜質,側重考查學生分析判斷及計算能力,題目難度不大.


 學而優銜接教材南京大學出版社系列答案
學而優銜接教材南京大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | SO2、H2S | B. | NH3、CO2 | C. | Cl2、CO2 | D. | SO2、Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 化合物AX3和單質X2在一定條件下反應可生成化合物AX5.回答下列問題.
化合物AX3和單質X2在一定條件下反應可生成化合物AX5.回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗序號 | 滴定前讀數/mL | 滴定后讀數/mL |
| 1 | 0.00 | 19.96 |
| 2 | 3.26 | 23.30 |
| 3 | 1.10 | 23.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 大于32.8% | B. | 小于32.8% | C. | 等于32.8% | D. | 約等于32.8% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 一定溫度下,將1mol A和1mol B氣體充入2L密閉容器,發生反應A(g)+B(g)?xC(g)+D(s),t1時達到平衡.在t2、t3時刻分別改變反應的一個條件,測得容器中氣體C的濃度隨時間變化如圖所示.下列說法正確是( )
一定溫度下,將1mol A和1mol B氣體充入2L密閉容器,發生反應A(g)+B(g)?xC(g)+D(s),t1時達到平衡.在t2、t3時刻分別改變反應的一個條件,測得容器中氣體C的濃度隨時間變化如圖所示.下列說法正確是( )| A. | 該反應方程式中的x=l | |
| B. | 0~t1時,用A表示的反應速率υ(A)=0.50mol/(L•min) | |
| C. | t2和t3時,改變的條件分別是加入催化劑和移去少量物質D | |
| D. | t1~t3間,該反應的平衡常數均為4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容器體積不變,充入與反應體系不反應的N2,反應速率不變;壓強不變,充入N2,反應速率減小 | |
| B. | 升高溫度時,正反應速率增大,逆反應速率也一定增大 | |
| C. | 恒溫恒容下,若X、Y起始物質的量之比為2:1,則X、Y的轉化率始終相等 | |
| D. | 恒溫恒壓下,該反應達到平衡后若只增加Z的量,重新達到平衡,各物質的物質的量之比可能不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com