
|
CH4的燃燒熱為890 kJ·mol-1.下列熱化學方程式正確的是 | |
| [ ] | |
A. |
CH4(g)+2O2(g) |
B. |
CH4+2O2 |
C. |
CH4(g)+2O2(g) |
D. |
CH4(g)+2O2(g) |
科目:高中化學 來源: 題型:




查看答案和解析>>
科目:高中化學 來源:2010-2011學年四川省成都市高三第一次診斷性檢測(理綜)化學部分 題型:填空題
據報道,在西藏凍土的一定深度下,發現了儲量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常溫常壓下,“可燃冰”會發生分解反應,其化學方程式是 。
(2)甲烷可制成合成氣(CO、H2),再制成甲醇,代替日益供應緊張的燃油。
①在101 KPa時,1.6 g CH4(g)與H2O(g)反應生成CO、H2,吸熱20.64 kJ。則甲烷與H2O(g)反應的熱化學方程式: 。
②CH4不完全燃燒也可制得合成氣:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。則從原料選擇和能源利用角度,比較方法①和②,合成甲醇的適宜方法為(填序號);原因是 。
③在溫度為T,體積為10L的密閉容器中,加入1 mol CO、2 mol H2,發生反應
CO(g)+ 2H2(g) CH3OH(g);△H=-Q kJ·mol-1(Q>O),達到平衡后的壓強是開始時壓強的0.6倍,放出熱量Q1kJ。
CH3OH(g);△H=-Q kJ·mol-1(Q>O),達到平衡后的壓強是開始時壓強的0.6倍,放出熱量Q1kJ。
I.H2的轉化率為 ;
II.在相同條件下,若起始時向密閉容器中加入a mol CH3 OH(g),反應平衡后吸收熱量Q2 kJ,且Q1+Q2=Q,則a= mol。
III.已知起始到平衡后的CO濃度與時間的變化關系如右圖所示。則t1時將體積變為5L后,平衡向 反應方向移動(填“正”或“逆”);

在上圖中畫出從tl開始到再次達到平衡后,
CO濃度與時間的變化趨勢曲線。
(3)將CH4設計成燃料電池,其利用率更高,裝置示意如右圖(A、B為多孔性碳棒)。

持續通人甲烷,在標準狀況下,消耗甲烷體積VL。
①O<V≤44.8 L時,電池總反應方程式為 ;
②44.8 L<V≤89.6 L時,負極電極反應為 ;
③V=67.2 L時,溶液中離子濃度大小關系為 ;
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
據報道,在西藏凍土的一定深度下,發現了儲量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常溫常壓下,“可燃冰”會發生分解反應,其化學方程式是 。
(2)甲烷可制成合成氣(CO、H2),再制成甲醇,代替日益供應緊張的燃油。
①在101 KPa時,1.6 g CH4(g)與H2O(g)反應生成CO、H2,吸熱20.64 kJ。則甲烷與H2O(g)反應的熱化學方程式: 。
②CH4不完全燃燒也可制得合成氣:CH4(g)+![]() O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。則從原料選擇和能源利用角度,比較方法①和②,合成甲醇的適宜方法為(填序號);原因是 。
③在溫度為T,體積為10L的密閉容器中,加入1 mol CO、2 mol H2,發生反應
CO(g)+ 2H2(g)![]() CH3OH(g);△H=-Q kJ·mol-1(Q>O),達到平衡后的壓強是開始時壓強的0.6倍,放出熱量Q1kJ。
CH3OH(g);△H=-Q kJ·mol-1(Q>O),達到平衡后的壓強是開始時壓強的0.6倍,放出熱量Q1kJ。
I.H2的轉化率為 ;
II.在相同條件下,若起始時向密閉容器中加入a mol CH3 OH(g),反應平衡后吸收熱量Q2 kJ,且Q1+Q2=Q,則a= mol。
III.已知起始到平衡后的CO濃度與時間的變化關系如右圖所示。則t1時將體積變為5L后,平衡向 反應方向移動(填“正”或“逆”);
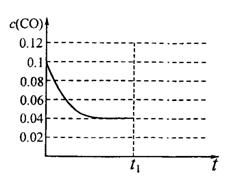
在上圖中畫出從tl開始到再次達到平衡后,
CO濃度與時間的變化趨勢曲線。
(3)將CH4設計成燃料電池,其利用率更高,裝置示意如右圖(A、B為多孔性碳棒)。
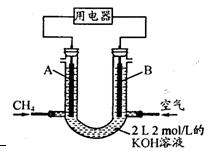
持續通人甲烷,在標準狀況下,消耗甲烷體積VL。
①O<V≤44.8 L時,電池總反應方程式為 ;
②44.8 L<V≤89.6 L時,負極電極反應為 ;
③V=67.2 L時,溶液中離子濃度大小關系為 ;
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
據報道,在西藏凍土的一定深度下,發現了儲量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常溫常壓下,“可燃冰”會發生分解反應,其化學方程式是 。
(2)甲烷可制成合成氣(CO、H2),再制成甲醇,代替日益供應緊張的燃油。
①在101 KPa時,1.6 g CH4(g)與H2O(g)反應生成CO、H2,吸熱20.64 kJ。則甲烷與H2O(g)反應的熱化學方程式: 。
②CH4不完全燃燒也可制得合成氣:CH4(g)+![]() O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H=-35.4 kJ·mol-1。則從原料選擇和能源利用角度,比較方法①和②,合成甲醇的適宜方法為(填序號);原因是 。
③在溫度為T,體積為10L的密閉容器中,加入1 mol CO、2 mol H2,發生反應
CO(g)+ 2H2(g)![]() CH3OH(g);△H=-Q kJ·mol-1(Q>O),達到平衡后的壓強是開始時壓強的0.6倍,放出熱量Q1kJ。
CH3OH(g);△H=-Q kJ·mol-1(Q>O),達到平衡后的壓強是開始時壓強的0.6倍,放出熱量Q1kJ。
I.H2的轉化率為 ;
II.在相同條件下,若起始時向密閉容器中加入a mol CH3 OH(g),反應平衡后吸收熱量Q2 kJ,且Q1+Q2=Q,則a= mol。
III.已知起始到平衡后的CO濃度與時間的變化關系如右圖所示。則t1時將體積變為5L后,平衡向 反應方向移動(填“正”或“逆”);
在上圖中畫出從tl開始到再次達到平衡后,
CO濃度與時間的變化趨勢曲線。
(3)將CH4設計成燃料電池,其利用率更高,裝置示意如右圖(A、B為多孔性碳棒)。
持續通人甲烷,在標準狀況下,消耗甲烷體積VL。
①O<V≤44.8 L時,電池總反應方程式為 ;
②44.8 L<V≤89.6 L時,負極電極反應為 ;
③V=67.2 L時,溶液中離子濃度大小關系為 ;
查看答案和解析>>
科目:高中化學 來源:2011屆四川省成都市高三第一次診斷性檢測(理綜)化學部分 題型:填空題
據報道,在西藏凍土的一定深度下,發現了儲量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常溫常壓下,“可燃冰”會發生分解反應,其化學方程式是 。
(2)甲烷可制成合成氣(CO、H2),再制成甲醇,代替日益供應緊張的燃油。
①在101 KPa時,1.6 g CH4(g)與H2O(g)反應生成CO、H2,吸熱20.64 kJ。則甲烷與H2O(g)反應的熱化學方程式: 。
②CH4不完全燃燒也可制得合成氣:CH4(g)+ O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);
△H="-35.4" kJ·mol-1。則從原料選擇和能源利用角度,比較方法①和②,合成甲醇的適宜方法為(填序號);原因是 。
③在溫度為T,體積為10L的密閉容器中,加入1 mol CO、2 mol H2,發生反應
CO(g)+ 2H2(g) CH3OH(g);△H="-Q" kJ·mol-1(Q>O),達到平衡后的壓強是開始時壓強的0.6倍,放出熱量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),達到平衡后的壓強是開始時壓強的0.6倍,放出熱量Q1kJ。
I.H2的轉化率為 ;
II.在相同條件下,若起始時向密閉容器中加入a mol CH3 OH(g),反應平衡后吸收熱量Q2 kJ,且Q1+Q2=Q,則a= mol。
III.已知起始到平衡后的CO濃度與時間的變化關系如右圖所示。則t1時將體積變為5L后,平衡向 反應方向移動(填“正”或“逆”);
在上圖中畫出從tl開始到再次達到平衡后,
CO濃度與時間的變化趨勢曲線。
(3)將CH4設計成燃料電池,其利用率更高,裝置示意如右圖(A、B為多孔性碳棒)。
持續通人甲烷,在標準狀況下,消耗甲烷體積VL。
①O<V≤44.8 L時,電池總反應方程式為 ;
②44.8 L<V≤89.6 L時,負極電極反應為 ;
③V=67.2 L時,溶液中離子濃度大小關系為 ;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com