
【題目】一定溫度下,在2L的密閉容器中充入0.4mol SO2和0.2mol O2,發生反應:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,n(O2)隨時間的變化關系如圖實線所示:
2SO3(g)△H<0,n(O2)隨時間的變化關系如圖實線所示:
(1)該溫度下反應的平衡常數K為_______________(不用帶單位),升高溫度K值將_______________(填增大、不變或減小,下同)。
(2)若溫度不變,在容器中再加1mol O2,重新達到平衡,則SO2的平衡濃度將_______________,氧氣的轉化率將_______________,SO3的體積分數將_______________。
(3)僅改變某一實驗條件再進行兩次實驗,測得O2的物質的量隨時間變化如圖中虛線所示,曲線Ⅰ改變的實驗條件是_______________,曲線Ⅱ改變的實驗條件是_______________。
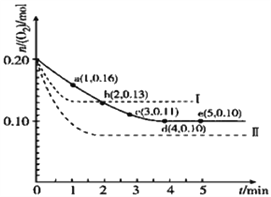
【答案】 20 減小 減小 減小 減小 升高溫度 增大壓強
【解析】試題分析:(1)由題意和圖中實線可知,SO2、O2的起始濃度分別為0.2mol/L、0.1mol/L,O2的平衡濃度分別為0.05mol/L,由2 SO2(g)+O2(g)![]() 2 SO3(g)可知,SO2(g)、O2(g)、SO3(g)的平衡濃度分別為0.1mol/L、0.05mol/L、0.1mol/L,該溫度下反應的平衡常數K =
2 SO3(g)可知,SO2(g)、O2(g)、SO3(g)的平衡濃度分別為0.1mol/L、0.05mol/L、0.1mol/L,該溫度下反應的平衡常數K =![]() =
=![]() =" 20" Lmol-1;2 SO2(g)+O2(g)
=" 20" Lmol-1;2 SO2(g)+O2(g)![]() 2 SO3(g)的正反應是ΔH < 0的放熱反應,升溫導致平衡向吸熱方向或逆反應方向移動,則平衡常數K減小;(2)若溫度不變,在容器中再加1 mol O2,增大氧氣濃度,平衡向正反應方向移動,則重新達到平衡,則SO2的平衡濃度將減小;氧氣的轉化率將減小,雖然其變化濃度增大,但c(O2)起始與c(O2)加入之和增大的程度更大,由
2 SO3(g)的正反應是ΔH < 0的放熱反應,升溫導致平衡向吸熱方向或逆反應方向移動,則平衡常數K減小;(2)若溫度不變,在容器中再加1 mol O2,增大氧氣濃度,平衡向正反應方向移動,則重新達到平衡,則SO2的平衡濃度將減小;氧氣的轉化率將減小,雖然其變化濃度增大,但c(O2)起始與c(O2)加入之和增大的程度更大,由![]() 可知,氧氣的平衡轉化率降低;原平衡時,SO3的體積分數=
可知,氧氣的平衡轉化率降低;原平衡時,SO3的體積分數=![]() =40%;若溫度不變,在容器中再加1 mol O2,平衡右移,設氧氣的變化濃度為xmol/L,重新達到平衡時,SO2(g)、O2(g)、SO3(g)的平衡濃度分別為(0.1-2x)mol/L、(0.65-x)mol/L、(0.1+2x)mol/L,SO3的體積分數=
=40%;若溫度不變,在容器中再加1 mol O2,平衡右移,設氧氣的變化濃度為xmol/L,重新達到平衡時,SO2(g)、O2(g)、SO3(g)的平衡濃度分別為(0.1-2x)mol/L、(0.65-x)mol/L、(0.1+2x)mol/L,SO3的體積分數=![]() ,由于正反應不能進行到底,則SO3的體積分數介于
,由于正反應不能進行到底,則SO3的體積分數介于![]() =11.8%和
=11.8%和![]() =25%之間,則SO3的體積分數比原平衡時減小;(3)從實線到虛線中的曲線I,達到平衡的時間縮短且氧氣的平衡濃度增大,說明平衡向逆反應方向移動且反應速率加快,由于2 SO2(g)+O2(g)
=25%之間,則SO3的體積分數比原平衡時減小;(3)從實線到虛線中的曲線I,達到平衡的時間縮短且氧氣的平衡濃度增大,說明平衡向逆反應方向移動且反應速率加快,由于2 SO2(g)+O2(g)![]() 2 SO3(g)的正反應是ΔH < 0的放熱反應,因此采取的措施是升高溫度;從實線到虛線中的曲線II,達到平衡的時間縮短且氧氣的平衡濃度減小,說明平衡向正反應方向移動且反應速率加快,由于2 SO2(g)+O2(g)
2 SO3(g)的正反應是ΔH < 0的放熱反應,因此采取的措施是升高溫度;從實線到虛線中的曲線II,達到平衡的時間縮短且氧氣的平衡濃度減小,說明平衡向正反應方向移動且反應速率加快,由于2 SO2(g)+O2(g)![]() 2 SO3(g)的正反應是氣體體積減小的方向,因此采取的措施是增大壓強或縮小容器的容積。
2 SO3(g)的正反應是氣體體積減小的方向,因此采取的措施是增大壓強或縮小容器的容積。


科目:高中化學 來源: 題型:
【題目】2012年中國汽車銷量大幅增長,同時也帶來了嚴重的空氣污染.汽車尾氣裝置中,氣體在催化劑表面吸附與解吸的過程如圖所示,下列說法正確的是( ) 
A.反應中NO為氧化劑,N2為氧化產物
B.汽車尾氣的主要污染成分包括CO、NO和N2
C.NO和O2必須在催化劑表面才能反應
D.催化轉化總反應為2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國明代《本草綱目》中收載藥物1892種,其中“燒酒”條目下寫道:“自元時始創其法,用濃酒和糟入甑,蒸令氣上,用器承取滴露。”這里所用的“法”是指
A. 萃取 B. 過濾 C. 蒸餾 D. 干餾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將a mol Na和amol Al一同投入m g足量水中,所得溶液密度為dg·㎝-3,該溶液的質量分數為
A.82a /(46a + m)%B.82000a /(46a + 2m)%
C.8200a /(46a + m)%D.8200a /(69a +2 m)%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與環境、工農業生產等密切相關,下列敘述正確的是( )
A.光化學煙霧與大量排放碳氫化合物和氮氧化合物有關
B.將草木灰和硫酸銨混合施用,肥效更高
C.棉花的主要成分是纖維素,石英玻璃、陶瓷和水泥均屬于硅酸鹽產品
D.硫酸工業尾氣未經處理就直接排放,將直接導致“溫室效應”
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2O2作為氧化劑在反應時不產生污染物被稱為綠色氧化劑,因而受到人們越來越多的關注。為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗。請回答下列問題:
(1)定性分析:圖甲可通過觀察_______________________________________定性比較得出結論。有同學提出將FeCl3溶液改為Fe2(SO4)3溶液更合理,其理由是_____________________________。
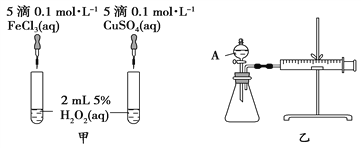
(2)定量分析:如圖乙所示,實驗時均以生成40 mL氣體為準,其他可能影響實驗的因素均已忽略。檢查該裝置氣密性的方法是:關閉A的活塞,將注射器活塞向外拉出一段后松手,過一段時間后看__________________________,實驗中需要測量的數據是____________________________________________________。
(3)課本在研究濃度對反應速率影響的實驗中,酸性高錳酸鉀和弱酸草酸反應的離子方程式為____________________________________________________,反應開始一段時間后反應速率明顯提升的原因是_________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把2.5 mol A和2.5 mol B混合盛入容積為2 L的密閉容器里,發生如下反應:3A(g)+B(g)![]() xC(g)+2D(g),經5 s反應達平衡,在此5 s內C的平均反應速率為0.2 mol· (L·s)-1,同時生成1 mol D,下列敘述中錯誤的是( )
xC(g)+2D(g),經5 s反應達平衡,在此5 s內C的平均反應速率為0.2 mol· (L·s)-1,同時生成1 mol D,下列敘述中錯誤的是( )
A. 達到平衡狀態時A的轉化率為50%
B. x=4
C. 達到平衡狀態時容器內氣體的壓強與起始時壓強比為6∶5
D. 5 s內B的反應速率v(B)=0.05 mol · (L·s)-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是批量生產的筆記本電腦所用的甲醇燃料電池的結構示意圖。甲醇在催化劑作用下提供質子(H+)和電子。電子經外電路、質子經內電路到達另一極與氧氣反應。電池總反應式為:2CH3OH+3O2=2CO2+4H2O。下列說法中正確的是 ( )

A. 左邊的電極為電池的負極,a處通入的是甲醇
B. 右邊的電極為電池的負極,b處通入的是空氣
C. 電池負極的反應式為:CH3OH+H2O+6e-=CO2+6H+
D. 電池的正極反應式為:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下按如圖安裝好實驗裝置,在錐形瓶內盛6.5 g鋅粒(顆粒大小基本相同),通過分液漏斗加入40 mL 2.5 mol·L-1的硫酸溶液,將產生的H2收集在一個注射器中,用時10 s時恰好收集到氣體的體積為50 mL(若折合成0 ℃、101 kPa條件下的H2體積為44.8 mL),在該溫度下,下列說法不正確的是( )
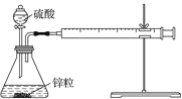
A. 可以通過測定鋅粒減少質量來測定反應速率
B. 忽略錐形瓶內溶液體積的變化,用H+來表示10 s內該反應的速率為0.01 mol·L-1·s-1
C. 忽略錐形瓶內溶液體積的變化,用Zn2+來表示10 s內該反應速率為0.01 mol·L-1·s-1
D. 用H2來表示10 s內該反應的速率為0. 000 2 mol·s-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com