
固定和利用CO2能有效地利用資源,并減少空氣中的溫室氣體。工業上有一種用CO2來生產甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g)
△H=-49.0 kJ·mol-1
某科學實驗將6molCO2和8molH2充入2L的密閉容器中,測得H2的物質的量隨時間變化如下圖所示(實線)。

(1)a點正反應速率_______(填大于、等于或小于)逆反應速率。
(2)下列時間段平均反應速率最大的是___________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)僅改變某一實驗條件再進行兩次實驗,測得H2的物質的量隨時間變化如圖中虛線所示,曲線I對應的實驗條件改變是___________,曲線II對應的實驗條件改變是___________。
(8分)(1)大于(2分)(2)A(2分) (3)升高溫度(2分) 增大壓強(2分)
【解析】
試題分析:(1)a點時還沒有達到平衡狀態,反應物氫氣的物質的量繼續減小,平衡向正向移動,所以正反應速率大于逆反應速率。
(2)分別計算不同時間內的反應速率:0~1min內,v(H2)=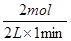 =1mol/(L?min);在1~3min內,v(H2)=
=1mol/(L?min);在1~3min內,v(H2)=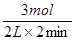 =0.75mol/(L?min);在3~8min內,v(H2)=
=0.75mol/(L?min);在3~8min內,v(H2)= =0.1mol/(L?min);根據圖像可知,反應進行到8min時物質的濃度不再發生變化,反應達到平衡狀態,則在8~11min內反應速率仍然是0.1mol/(L?min),所以0~1min內反應速率最大,故答案為A。
=0.1mol/(L?min);根據圖像可知,反應進行到8min時物質的濃度不再發生變化,反應達到平衡狀態,則在8~11min內反應速率仍然是0.1mol/(L?min),所以0~1min內反應速率最大,故答案為A。
(3)曲線I反應速率增大,但轉化的氫氣的物質的量少,應該是升高溫度,因該反應放熱,升高溫度平衡逆向移動,不利于氫氣的轉化,故曲線I是升高溫度;曲線Ⅲ反應速率增大,轉化的氫氣的物質的量多,因增大壓強平衡正向移動,故應是增大壓強。
考點:考查反應速率的計算、外界條件對反應速率和平衡狀態的影響
點評:該題是中等難度試題的考查,也是高考中的常見題型。主要是考查學生對反應速率計算以及外界條件影響反應速率和平衡狀態的熟悉了解程度,旨在培養學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的邏輯思維能力和靈活應變能力。答題時注意把握對題目圖象的分析和理解。


科目:高中化學 來源: 題型:

 通過消去反應制備Ⅰ的化學方程式為
通過消去反應制備Ⅰ的化學方程式為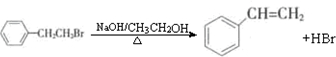
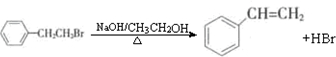


 (任寫一種)
(任寫一種) (任寫一種)
(任寫一種) 和H2三者發生反應(苯環不參與反應),生成化合物Ⅵ和Ⅶ,其分子式均為C9H8O,且都能發生銀鏡反應.下列關于Ⅵ和Ⅶ的說法正確的有
和H2三者發生反應(苯環不參與反應),生成化合物Ⅵ和Ⅶ,其分子式均為C9H8O,且都能發生銀鏡反應.下列關于Ⅵ和Ⅶ的說法正確的有查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
 固定和利用CO2能有效地利用資源,并減少空氣中的溫室氣體.工業上有一種用CO2來生產甲醇燃料的方法:
固定和利用CO2能有效地利用資源,并減少空氣中的溫室氣體.工業上有一種用CO2來生產甲醇燃料的方法: CH3OH(g)+H2O(g)+49kJ
CH3OH(g)+H2O(g)+49kJ查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源:2015屆甘肅省高二上學期期末考試化學試卷(解析版) 題型:填空題
固定和利用CO2能有效地利用資源,并減少空氣中的溫室氣體。工業上有一種用CO來生產甲醇燃料的方法: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =
-49.0 kJ·mol-1,
CH3OH(g)+H2O(g) △H =
-49.0 kJ·mol-1,
某科學實驗將6molCO2和8molH2充入2L的密閉容器中,測得H2的物質的量隨時間變化如下圖所示(實線)。

(1)a點正反應速率_______(填大于、等于或小于)逆反應速率。
(2)下列時間段平均反應速率最大的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡時CO2的轉化率 和該條件下的平衡常數K 。
(4)僅改變某一實驗條件再進行兩次實驗,測得H2的物質的量隨時間變化如圖中虛線所示,曲線I對應的實驗條件改變是 ,曲線II對應的實驗條件改變是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com