
在100℃時,將0.50 mol N2O4氣體通入到體積為5.0 L的真空密閉容器中立即出現紅棕色,反應進行到2秒時,NO2的濃度為0.02 mol/L,60秒時體系已達平衡,此時容器內壓強為開始的1.6倍,下列說法正確的是
A.前2秒以N2O4的濃度變化表示的平均反應速率為0.010 mol/(L?s)
B.在2秒時體系內壓強為開始時的1.1倍
C.平衡時體系內含N2O4 為0.25mol
D.平衡時如果壓縮容器體積,則可以提高N2O4的轉化率
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
| 時間(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 在100℃時,將0.40mol二氧化氮氣體充入2L抽空的密閉容器中,每隔一定時間就對該容器內的物質進行分析,得到如下表數據:
在100℃時,將0.40mol二氧化氮氣體充入2L抽空的密閉容器中,每隔一定時間就對該容器內的物質進行分析,得到如下表數據:| 時間(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |


查看答案和解析>>
科目:高中化學 來源: 題型:
在100℃時,將0.40molNO2氣體充入2L密閉容器中,每隔一段時間對該容器的物質進行測量,得到的數據如下表:
|
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 非金屬元素氮有多種氧化物,如NO、NO2、N2O4等.
非金屬元素氮有多種氧化物,如NO、NO2、N2O4等.| 時間(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:
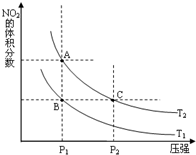 氮可形成多種氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互轉化.
氮可形成多種氧化物,如NO、NO2、N2O4等,NO2和N2O4可以相互轉化.| 時間(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com