

| 物質 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
分析 (1)依據鋁熱反應原理可知:高溫條件下,Al和Mn3O4發生置換反應生成Mn和氧化鋁;
(2)軟錳礦還原浸出得到硫酸錳溶液,說明浸取液為稀硫酸,同時溶液中還含有Ca2+、Fe3+、Cu2+等雜質,調節溶液的pH,Fe(OH)3pKap為37.4與其它離子相比最大,調節pH可以將 Fe(OH)3沉淀下來,向濾液中加入硫化銨,CuSpKap為35.2,可以將銅離子形成硫化物沉淀下來,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后對得到的含有錳離子的鹽電解,可以得到金屬錳;
(3)錳離子和碳酸氫根離子反應生成碳酸錳沉淀、水和二氧化碳氣體,根據反應物和生成物書寫方程式;K=$\frac{c(C{O}_{3}{\;}^{2}{\;}^{-})}{{c}^{2}(OH{\;}^{-})}$=$\frac{\frac{{K}_{sp}(MnC{O}_{3})}{c(M{n}^{2}{\;}^{+})}}{\frac{{K}_{sp}[Mn(OH)_{{\;}_{2}}]}{c(Mn{{\;}^{2}}^{+})}}$;
解答 解:(1)高溫條件下,Al和Mn3O4發生置換反應生成Mn和氧化鋁,化學方程式:8Al+3Mn3O4$\frac{\underline{\;高溫\;}}{\;}$4Al2O3+9Mn,
故答案為:8Al+3Mn3O4$\frac{\underline{\;高溫\;}}{\;}$4Al2O3+9Mn;
(2)①軟錳礦還原浸出的反應為:12MnO2+C6H12O6+12H2SO4═12MnSO4+6CO2↑+18H2O,反應中C6H12O6中的碳元素化合價升高,所以C6H12O6做還原劑;
提高溫度能夠加快反應速率;
故答案為:C6H12O6;升高反應溫度;
②軟錳礦還原浸出的反應為:12MnO2+C6H12O6+12H2SO4=12MnSO4+6CO2↑+18H2O,溶液呈強酸性,還原浸出液中含有Mn2+、Ca2+、Fe3+、Cu2+,此時未形成沉淀,Kp為電離平衡常數,pKp=-1gKp,pKp越大,沉淀溶解平衡常數越小,濾液1為形成Fe(OH)3沉淀,pKp=-1gKp=37.4,Kp=10-37.4,Kp=c(Fe3+)×c3(OH-)=10-37.4,c(OH-)≈10-10,c(H+)=1×10-4mol/L,pH=4,所以濾液1的pH大于MnSO4浸出液的pH=4才能形成氫氧化鐵沉淀,
故答案為:>;
③CaF2難溶于水,濾液2為Mn2+、Ca2+、NH4+、SO42-,加入MnF2的目的除去形成CaF2沉淀,除去Ca2+,故答案為:Ca2+;
(3)錳離子和碳酸氫根離子反應生成碳酸錳沉淀、水和二氧化碳氣體,離子方程式為Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;由MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq)可知,K=$\frac{c(C{O}_{3}{\;}^{2}{\;}^{-})}{{c}^{2}(OH{\;}^{-})}$=$\frac{\frac{{K}_{sp}(MnC{O}_{3})}{c(M{n}^{2}{\;}^{+})}}{\frac{{K}_{sp}[Mn(OH)_{{\;}_{2}}]}{c(Mn{{\;}^{2}}^{+})}}$=$\frac{1{0}^{-10.7}}{10{\;}^{-12.7}}$=100.
故答案為:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;100.
點評 本題為工藝流程題,涉及物質的提純與分離、離子方程式的書寫、有關kSP、K的計算、氧化還原反應基本概念,熟悉相關理論是解題關鍵,題目難度中等.


 直通貴州名校周測月考直通名校系列答案
直通貴州名校周測月考直通名校系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 全部 | B. | ①②⑤ | C. | ② | D. | ②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
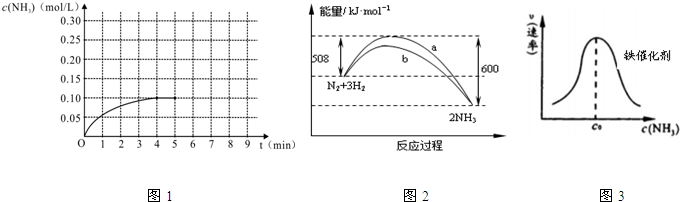
 分別表示N2、H2、NH3和固體催化劑,則在固體催化劑表面合成氨的過程可用下圖表示:
分別表示N2、H2、NH3和固體催化劑,則在固體催化劑表面合成氨的過程可用下圖表示: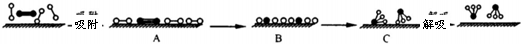
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 青蒿素易溶于水和酒精 | |
| B. | 青蒿素中含多個環狀結構,其中有一個六元碳環 | |
| C. | 青蒿素中含過氧鍵,過氧鍵屬于極性共價鍵 | |
| D. | 青蒿素和纖維素都屬于高分子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
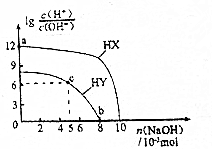
| A. | HX的酸性弱于HY | |
| B. | a點由水電離出的c(H+)=10-12mol•L-1 | |
| C. | c點溶液中:c(Y-)>c(HY) | |
| D. | b點時酸堿恰好完全中和 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 17.92L | B. | 22.4L | C. | 8.96L | D. | 11.2L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com