

分析 (1)由工藝流程可知混合反應中為SO2等與純堿(Na2CO3)的反應,SO2與純堿(Na2CO3)溶液反應生成Na2SO3(或NaHSO3)、CO2;
(2)混合反應中還溶解有少量Fe2O3、MgO等礦塵,混合反應后的溶液中含有少量的Fe2+、Mg2+、HSO3-等.Fe2+、Mg2+、HSO3-等都與OH-發生反應;
(3)從溶液中獲得固體物質應采取蒸發結晶方法;
(4)由圖象可知T0前反應未達平衡,T0時處于平衡狀態,T0后升高溫度平衡向逆反應移動.
A、T0后升高溫度平衡向逆反應移動,升高溫度平衡向吸熱反應移動;
B、溫度升高反應速率加快;
C、不同物質表示的正逆反應速率之比等于化學計量數之比,反應到達平衡狀態;
D、催化劑縮短到達平衡時間,平衡不移動.
解答 解:(1)SO2與純堿(Na2CO3)溶液反應的方程式為SO2+Na2CO3=Na2SO3+CO2↑或2 SO2+Na2CO3+H2O=NaHSO3+CO2↑,
故答案為:SO2+Na2CO3=Na2SO3+CO2↑或2 SO2+Na2CO3+H2O=NaHSO3+CO2↑;
(2)合反應后的溶液中含有少量的Fe2+、Mg2+、HSO3-等.Fe2+、Mg2+、HSO3-等都與OH-發生反應,發生反應離子方程式為Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O,
故答案為:Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O;
(3)從溶液中獲得固體物質應加熱蒸發、冷卻結晶、過濾、洗滌干燥,故答案為:冷卻結晶;過濾;
(4)由圖象可知T0前反應未達平衡,T0時處于平衡狀態,T0后升高溫度平衡向逆反應移動.
A、T0后升高溫度平衡向逆反應移動,升高溫度平衡向吸熱反應移動,故正反應為放熱反應,故A正確;
B、A未達平衡,B處于平衡狀態,反應速率比A點高,T0后溫度升高反應速率加快,平衡向逆反應移動,但比B點的速率高,所以:vA<vC,故B錯誤;
C、不同物質表示的正逆反應速率之比等于化學計量數之比,反應到達平衡狀態,反應達到B點時,到達平衡狀態,所以2v正(O2)=v逆(SO3),故C正確;
D、使用催化劑,加快反應速率,縮短到達平衡時間,但平衡不移動,用V2O5催化劑與Fe2O3作催化劑,到達平衡時三氧化硫的含量相同,故D錯誤;
故答案為:AC.
點評 本題考查制備實驗方案的設計,為高頻考點,把握制備流程中的反應及混合物分離方法為解答的關鍵,注意對工藝流程的理解及常用化學用語、化學平衡及圖象分析等,要求學生有扎實的基礎知識以及綜合運用知識解決問題的能力,綜合性較強,題目難度中等.


 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 苯的硝化、乙烯使高錳酸鉀酸性溶液褪色的反應都屬于取代反應 | |
| B. | 蛋白質、淀粉、油脂等都能在人體內水解并提供能量 | |
| C. | 乙烯、苯、乙烷分子中的所有原子都在同一平面上 | |
| D. | 石油裂解的主要目的是提高汽油等輕質油的產量與質量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等氣態短鏈烴 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖、油脂的漂白與殺菌.如圖是過氧化氫法生產亞氯酸鈉的工藝流程圖:
亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖、油脂的漂白與殺菌.如圖是過氧化氫法生產亞氯酸鈉的工藝流程圖:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
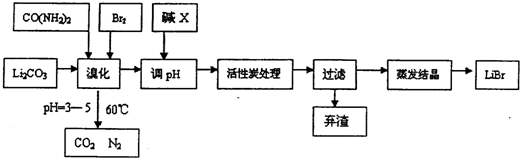
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
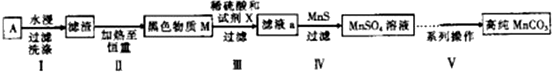
| 實驗編號 | 試劑X | MnSO4/g |
| 1 | 鋅粉 | 2.3595 |
| 2 | 鐵粉 | 2.7184 |
| 3 | 硫化亞鐵 | 2.9911 |
| 4 | 30%過氧化氫 | 3.7349 |
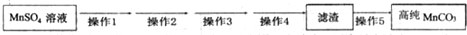
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ;Na2O2的電子式:
;Na2O2的電子式: ,H2S的電子式:
,H2S的電子式:
 .
. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com