
【題目】向100mL某物質的量濃度的NaOH溶液中緩慢通入一定量的CO2 , 充分反應后,向所得溶液中逐滴滴入1mol/L的鹽酸溶液,所得氣體的體積(標準狀態)與所加鹽酸的體積關系如圖所示 
(1)寫出OA段發生反應的離子方程式: .
(2)反應到B點時所得溶液中的溶質是 .
(3)原NaOH溶液的物質的量濃度是 .
【答案】
(1)H++OH﹣=H2O、CO32﹣+H+=HCO3﹣
(2)NaCl
(3)2.5mol/L
【解析】】解:當生成CO2氣體時,發生反應NaHCO3+HCl=NaCl+H2O+CO2↑,由圖可知,生成CO2氣體至最大,消耗鹽酸250mL,若二氧化碳與NaOH反應后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將Na2CO3轉化為NaHCO3應消耗鹽酸125mL,而圖象中開始生成CO2氣體時消耗鹽酸150mL,說明該階段還發生反應:NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3,(1)由上述分析可知OA段所發生反應的離子方程式:H++OH﹣═H2O、CO32﹣+H+═HCO3﹣,
故答案為:H++OH﹣═H2O、CO32﹣+H+═HCO3﹣;(2)生成CO2氣體最大時,此時溶液中溶質為NaCl,
故答案為:NaCl;(4)生成CO2氣體最大時,溶液中溶質為NaCl,根據鈉離子、氯離子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.25L×1mol/L=0.25mol,則原氫氧化鈉溶液的濃度為:c(NaOH)= ![]() =2.5mol/L,
=2.5mol/L,
故答案為:2.5mol/L.
當生成CO2氣體時,發生反應NaHCO3+HCl=NaCl+H2O+CO2↑,由圖可知,生成CO2氣體至最大,消耗鹽酸250mL,若二氧化碳與NaOH反應后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將Na2CO3轉化為NaHCO3應消耗鹽酸125mL,而圖象中開始生成CO2氣體時消耗鹽酸150mL,說明該階段還發生反應:NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3,據此進行解答.(1)根據分析書寫發生反應的離子方程式;(2)生成氣體達到最大時,反應后溶質為氯化鈉;(3)生成CO2氣體最大時,此時溶液中溶質為NaCl,根據鈉離子、氯離子守恒可知n(NaOH)=n(NaCl)=n(HCl),進而計算氫氧化鈉的濃度.


 數學奧賽暑假天天練南京大學出版社系列答案
數學奧賽暑假天天練南京大學出版社系列答案 南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案科目:高中化學 來源: 題型:
【題目】以2010年諾貝爾化學獎獲得者的名字命名的赫克反應、根岸反應和鈴木反應已成為化學家們制造復雜化學分子的“精致工具”,在科研、醫藥和電子等領域已經廣泛應用.下例生成物就是由鈴木反應合成出來的一種聯苯的衍生物:![]()
下列敘述正確的是( )
A.該反應為加成反應,且原子利用率達100%
B.該聯苯的衍生物屬于芳香烴
C.該聯苯的衍生物苯環上的一硝基取代產物有5種
D.該聯苯的衍生物不可使溴水褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】漢黃芩素是傳統中草藥黃芩的有效成分之一,對腫瘤細胞的殺傷有獨特作用.下列有關漢黃芩素的敘述正確的是( )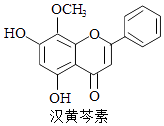
A.漢黃芩素的分子式為C16H13O5
B.該物質遇FeCl3溶液顯色
C.1 mol該物質與溴水反應,最多消耗1mol Br2
D.與足量H2發生加成反應后,該分子中官能團的種類減少1種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國的鐵礦資源儲量很豐富,其中以磁鐵礦(主要成分Fe3O4)和赤鐵礦(主要成分是Fe2O3)兩種礦石為主,某煉鋼廠欲用某種礦石作煉鐵原料,需要對這種礦石樣品分析,探究礦石中鐵的價態和測定鐵元素的含量,做了一些實驗. I.檢驗礦石樣品中是否有Fe2+和Fe3+
實驗操作步驟:
(1)過濾操作中用到的玻璃儀器有 .
(2)檢驗有Fe2+和Fe3+常用的化學試劑有:KSCN溶液、新制氯水、KMnO4溶液、H2O2溶液. ①檢驗Fe3+選 .
②設計實驗方案,證明該濾液中既有Fe2+又有Fe3+ .
(3)II.測定礦石中鐵元素的含量 若上述實驗中稱取28g礦石樣品,經過酸溶、過濾后得到200ml濾液,現取出20ml溶液裝于錐形瓶中,先向錐形瓶中加入足量酸化的SnCl2溶液,充分反應后,再加入HgCl2除去過量的SnCl2 , 最后滴入20ml0.25mol/L的K2Cr2O7溶液恰好完全反應,發生的主要反應如下:2FeCl3+SnCl2=2FeCl2+SnCl4;6Fe2++Cr2O72﹣+14H+=6Fe3++2Cr3++7H2O,計算礦石樣品中鐵元素的質量分數是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)H2S和SO2會對環境和人體健康帶來極大的危害,工業上采取多種方法減少這些有害氣體的排放,回答下列方法中的問題.
Ⅰ.H2S的除去
方法1:生物脫H2S的原理為:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫桿菌存在時,FeSO4被氧化的速率是無菌時的5×105倍,該菌的作用是 .
(2)由圖1和圖2判斷使用硫桿菌的最佳條件為 . 若反應溫度過高,反應速率下降,其原因是 . 
(3)方法2:在一定條件下,用H2O2氧化H2S
隨著參加反應的n(H2O2)/n(H2S)變化,氧化產物不同.當n(H2O2)/n(H2S)=4時,氧化產物的分子式為 .
(4)Ⅱ.SO2的除去
方法1(雙堿法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
寫出過程①的離子方程式:;CaO在水中存在如下轉化:
CaO(s)+H2O (l)═Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)
從平衡移動的角度,簡述過程②NaOH再生的原理 .
(5)方法2:用氨水除去SO2
已知25℃,NH3H2O的Kb=1.8×10﹣5 , H2SO3的Ka1=1.3×10﹣2 , Ka2=6.2×10﹣8 . 若氨水的濃度為2.0molL﹣1 , 溶液中的c(OH﹣)=molL﹣1 . 將SO2通入該氨水中,當c(OH﹣)降至1.0×10﹣7 molL﹣1時,溶液中的c(SO32﹣)/c(HSO3﹣)= .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于普通玻璃的敘述中,正確的是( )
A.它是人類最早使用的硅酸鹽材料
B.紅色玻璃中含氧化亞銅
C.它在加熱熔化時有固定的熔點
D.無色玻璃是純凈物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com