
 甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用如下反應來合成
甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用如下反應來合成| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)①依據平衡常數隨溫度變化判斷反應能量變化;
②壓縮體積相當于增大壓強,反應前后氣體體積減小的反應,結合平衡移動原理分析判斷;
③利用三段式計算;
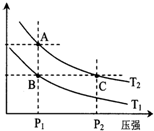
(2)A、C兩點都在等溫線上,壓強越大,反應速率越快;A、C兩點都在等溫線上,平衡常數只與溫度有關;該反應為放熱反應,升高溫度平衡向逆反應方向移動,H2的體積分數增大.
解答 解:(1)由表中數據可知溫度升高,K值減小,說明平衡向逆反應方向移動,逆反應為吸熱反應,正反應即為放熱反應△H<0,
故答案為:<;
(2)在其他條件不變的情況下,將容器的容積壓縮到原來的 $\frac{1}{2}$,體系壓強增大,各組分濃度增大,平衡常數不變;
A、將容器的容積壓縮到原來的 $\frac{1}{2}$,各組分濃度均增大,故A錯誤;
B、將容器的容積壓縮到原來的 $\frac{1}{2}$,各組分濃度均增大,正逆反應速率都增大,故B錯誤;
C、將容器的容積壓縮到原來的 $\frac{1}{2}$,體系壓強增大,化學平衡正向移動,CH3OH的物質的量增加,故C正確;
D、將容器的容積壓縮到原來的 $\frac{1}{2}$,體系壓強增大,化學平衡正向移動,CH3OH 的物質的量增大,H2的物質的量減小,又處于同一容器V相同,所以c(H2)/c(CH3OH)減小,故D正確;
故答案為:CD;
③利用三段式計算,
CO(g)+2H2(g)?CH3OH(g)
起始(mol) 2 6 0
轉化(mol) 1.6 3.2 1.6
平衡(mol) 0.2×2=0.4 2.8 1.6
平衡常數K=$\frac{\frac{1.6}{2}}{(\frac{2.8}{2})^{2}×\frac{0.4}{2}}$=2,所以對照表格溫度為250℃,
v(CH3OH)=$\frac{\frac{1.6}{2}}{10}$mol/(L•min)=0.08mol/(L•min)
故答案為:250℃;0.08;
(2)A、C兩點都在等溫線上,壓強越大,反應速率越快;A、C兩點都在等溫線上,平衡常數只與溫度有關;該反應為放熱反應,升高溫度平衡向逆反應方向移動,H2的體積分數增大,故答案為:<;=; 升溫.
點評 本題考查化學平衡計算、平衡常數及影響因素,注意平衡常數及單位與方程式中化學計量數有關,難度不大.


 智慧課堂密卷100分單元過關檢測系列答案
智慧課堂密卷100分單元過關檢測系列答案 單元期中期末卷系列答案
單元期中期末卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2O3$\frac{\underline{\;催化劑\;}}{\;}$ 3O2 | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高溫\;}}{\;}$Al2O3+2Fe | |
| C. | 3C12+2Fe $\frac{\underline{\;點燃\;}}{\;}$2FeCl3 | |
| D. | 2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向NH4HCO3溶液中加過量的NaOH溶液并加熱:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用惰性電極電解CuSO4溶液:2Cu2++2H2O═4H++O2↑+2Cu | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
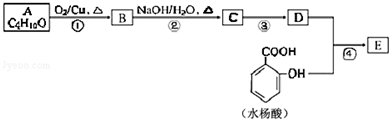
 ;
;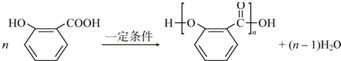 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
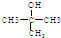 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com