
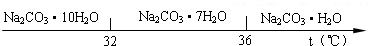
| 物質 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
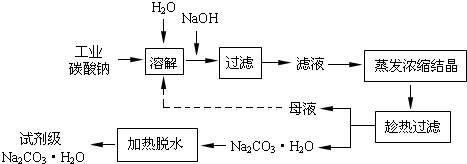
分析 (1)因工業碳酸鈉中含有Mg2+,Fe3+,Ca2+,所以“除雜”中加入過量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀;
(2)根據氫氧化鎂和氫氧化鐵的溶解平衡以及溶度積表達式,則當兩種沉淀共存且溶液的pH=8時,c(Mg2+)=$\frac{Ksp}{[OH{\;}^{-}]{\;}^{2}}$,(Fe3+)=$\frac{Ksp}{[OH{\;}^{-}]{\;}^{3}}$,據此計算;
(3)除去g2+,Fe3+,Ca2+,濾液中除了含有 Na+、CO32-離子外,還含有Cl-、SO42-;
(4)分析“母液”中存在的離子,若參與循環,將使離子濃度增大,對工業生產中哪個環節有所影響;
(5)已知:①Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1,②Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1,利用蓋斯定律,將①-②得到Na2CO3•H2O(S)═Na2CO3(s)+H2O(g),據此書寫熱化學方程式.
解答 解:(1)碳酸鈉中含有Mg2+,Fe3+,Ca2+,所以“除雜”中加入過量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀,濾渣的主要成分為Mg(OH)2、Fe(OH)3、CaCO3,發生的發應有:Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg (OH) 2↓+CO32-,
故答案為:Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2↓+CO32-;
(2)根據氫氧化鎂和氫氧化鐵的溶解平衡以及溶度積表達式,則當兩種沉淀共存且溶液的pH=8時,c(Mg2+)=$\frac{Ksp}{[OH{\;}^{-}]{\;}^{2}}$=$\frac{5.61×10{\;}^{-12}}{10{\;}^{-12}}$=5.61mol/L,c(Fe3+)=$\frac{Ksp}{[OH{\;}^{-}]{\;}^{3}}$=$\frac{2.64×10{\;}^{-39}}{10{\;}^{-18}}$=2.64×10-21mol/L,
所以 c(Mg2+):c(Fe3+)=5.61:2.64×10-21=2.125×1021,
故答案為:2.125×1021;
(3)碳酸鈉中含有Mg2+,Fe3+,Ca2+,所以“除雜”中加入過量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀,過濾后濾液中除了含有 Na+、CO32-離子外,還含有Cl-、SO42-,
故答案為:Cl-、SO42-;
(4)若“母液”循環使用,則溶液c(Cl-)和c(SO42-)增大,最后所得產物Na2CO3中混有雜質,這樣不符合該提純工藝,
故答案為:不可行;若“母液”循環使用,則溶液c(Cl-)和c(SO42-)增大,最后所得產物Na2CO3中混有雜質;
(5)已知:①Na2CO3•10H2O(s)═Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1,②Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1,利用蓋斯定律,將①-②得到Na2CO3•H2O(S)═Na2CO3(s)+H2O(g),即Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol,
故答案為:Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
點評 本題考查了物質的分離、提純及物質的制取等知識,題目難度中等,本題是一道比較綜合的試題題,有利于考查學生分析和解決問題的能力.


 津橋教育計算小狀元系列答案
津橋教育計算小狀元系列答案科目:高中化學 來源: 題型:解答題
 如圖表示A--E 五種物質的相互轉化關系,其中A為淡黃色粉末,C為單質,D為離子化合物.
如圖表示A--E 五種物質的相互轉化關系,其中A為淡黃色粉末,C為單質,D為離子化合物.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 量筒、酸式滴定管、水 | B. | 容量瓶、堿式滴定管、苯 | ||
| C. | 量筒、堿式滴定管、水 | D. | 容量瓶、酸式滴定管、四氯化碳 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| H2CO3 | K${\;}_{{a}_{1}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| I | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液體積/mL | 100 | 100 | 100 | 100 |
| 加入粉末質量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末質量/g | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 酸性介質中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | HCO3-的電離方程式:HCO3-+H2O═H2CO3+OH- | |
| D. | Cl2與H2O反應:Cl2+H2O═H++Cl-+HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | V(A)=0.15mol/(l•s) | B. | V(B)=0.6mol/(l•s) | C. | V(C)=0.45mol/(l•s) | D. | V(D)=4.0mol/(l•min) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com