
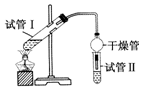
 乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.實驗室制備乙酸乙酯的化學方程式如下:CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.實驗室制備乙酸乙酯的化學方程式如下:CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O| 實驗編號 | 試管Ⅰ中試劑 | 試管Ⅱ中試劑 | 測得有機層的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1濃H2SO4 | 飽和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
分析 (1)根據平衡常數的定義判斷,為反應物與生成物的濃度冪之積的比值,注意水為純液體;
(2)①對比試驗關鍵是要采用控制變量,即控制一個變量,其它條件不變,所以可以從控制變量的角度來分析解答;
②根據實驗A和實驗B的數據進行解答;水在酯化反應中為生成物,從生成物對化學平衡的影響角度分析;
③乙酸和乙醇容易揮發,且溫度過高容易發生副反應.
解答 解:(1)水為純液體,則CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O的平衡常數表達式為K=$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$,
故答案為:$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$;
(2)①本題是研究實驗D與實驗C相對照,證明H+對酯化反應具有催化作用的條件,題中采用了一個變量,實驗C3mol•L-1 H2SO4,實驗D鹽酸,所以達到實驗目的,實驗D與實驗C中H+的濃度一樣,實驗C3mL乙醇、2mL乙酸、3mol•L-1 H2SO4,實驗D3mL乙醇、2mL乙酸、鹽酸,要保證溶液體積一致,才能保證乙醇、乙酸的濃度不變,鹽酸體積為6mL,實驗D與實驗C中H+的濃度一樣,所以鹽酸的濃度為6mol•L-1,
故答案為:6,6;
②對照實驗A和B可知:試管Ⅰ中試劑實驗A比實驗B多1mL18mol•L-1 濃硫酸,但是試管Ⅱ中試劑中測得有機層乙酸乙酯的厚度,實驗A為5.0cm,而實驗B只有0.1cm,說明濃硫酸的吸水性提高了乙酸乙酯的產率;酯化反應為可逆反應,濃硫酸吸收酯化反應生成的水,降低了生成物濃度,使平衡向生成乙酸乙酯方向移動,
故答案為:A;濃硫酸吸收酯化反應生成的水,降低了生成物濃度,使平衡向生成乙酸乙酯方向移動;
③乙酸與乙醇在濃硫酸作用下加熱發生酯化反應生成乙酸乙酯和水,該反應為可逆反應,實驗發現溫度過高,乙酸乙酯的產率反而降低,是由于乙酸、乙醇都易揮發,使產率降低,或因溫度過高可能發生副反應使產率降低,如乙醇在140℃,在濃硫酸催化下脫水生成乙醚,
故答案為:乙酸、乙醇都易揮發,溫度過高可能使乙酸、乙醇大量揮發使產率降低,溫度過高可能發生副反應使產率降低.
點評 本題考查了乙酸乙酯的制備方法,為高頻考點,題目還涉及溫度對反應速率、化學平衡的影響等知識,題目難度中等,注意把握乙酸乙酯的制備原理和實驗方法,明確影響反應速率、化學平衡的因素.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:推斷題
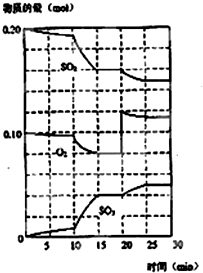 在一定條件下,二氧化硫和氧氣發生如圖反應:
在一定條件下,二氧化硫和氧氣發生如圖反應:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實 驗 事 實 | 結 論 | |
| ① | SO2使酸性高錳酸鉀溶液褪色 | 可證明SO2有漂白性 |
| ② | 濃鹽酸可除去燒瓶內殘留的MnO2,稀硝酸可除去試管內壁的銀鏡,用磨口玻璃瓶不能保存NaOH溶液 | 都發生了氧化還原反應 |
| ③ | 取少量Na2SO3樣品加入Ba(NO3)2溶液后,產生白色沉淀,滴加稀鹽酸,沉淀不溶解 | 證明Na2SO3已氧化變質 |
| ④ | 某溶液只含一種溶質,加入稀鹽酸產生能使澄清石灰水變渾濁的無色無味氣體,向該溶液中滴加BaCl2溶液,有白色沉淀生成 | 確定該溶液中存在CO32- |
| ⑤ | 某無色溶液中加入濃氫氧化鈉溶液并加熱,產生的氣體能使濕潤藍色石蕊試紙變紅 | 該溶液一定有NH4+ |
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在密閉容器中加入l.5mol H2和0.5molN2,充分反應后得到NH3分子數為NA | |
| B. | 一定條件下,2.3g的Na完全與O2反應生成3.5g產物時失去的電子數為0.1NA | |
| C. | 1.0L的0.1 mol•L-1Na2CO3溶液中含有的CO32-離子數為0.1NA | |
| D. | 標準狀況下,11.2L的CCl4中含有的CCl4分子數為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
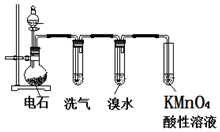 如圖為實驗室制取乙炔并驗證其性質的裝置圖,回答下列問題:
如圖為實驗室制取乙炔并驗證其性質的裝置圖,回答下列問題: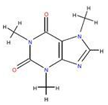 ,實驗室可通過下列簡單方法從茶葉中提取咖啡因:
,實驗室可通過下列簡單方法從茶葉中提取咖啡因: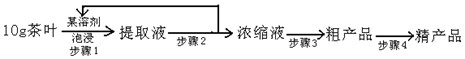
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質量數為94 | B. | 中子數為144 | C. | 質子數為238 | D. | 電子數為144 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
時間/min 濃度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com