
(1)0.7 mol H2O的質量為____________,其中含有_________個水分子,氫原子的物質的量為__________。
(2)質量相同的H2、NH3、SO2、O3四種氣體中,含有分子數目最少的是_________,在相同溫度和相同壓強條件下,體積最大的是___________。
(3)在_______mL 0.2 mo1·L-1 NaOH溶液(密度為1 g·cm-3)中含1g溶質;配制50mL0.2 mo1·L-1 CuSO4溶液,需要CuSO4·5H2O__________g。
(1)12.6g,4.214×1023 ,1.4mol (2)SO2 ,H2 (3)125 2.5
【解析】考查有關物質的量的計算。
(1)水的摩爾質量是18g/mol,所以0.7mol水的質量是m=M·n=0.7mol×18g/mol=12.6g。根據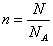 可知,含有的水分子是0.7mol×6.02×1023/mol=4.214×1023。1個水分子含有2個氫原子,所以含有0.7mol×2=1.4mol氫原子。
可知,含有的水分子是0.7mol×6.02×1023/mol=4.214×1023。1個水分子含有2個氫原子,所以含有0.7mol×2=1.4mol氫原子。
(2)根據n=m/M可知,在質量相等的條件小,氣體的摩爾質量越大,物質的量越小,含有的分子數目越小,因此分子數目最小的是SO2。根據阿伏加德羅常數可知,氣體的物質的量越多,體積越大,所以應該是氫氣。
(3)1g氫氧化鈉是1g÷40g/mol=0.025mol,所以溶液的體積是V=0.025mol÷0.2mol/L=0.125L=125ml。50mL0.2 mo1·L-1 CuSO4溶液中溶質的物質的量是0.05L×0.2mol/L=0.01mol,因此需要CuSO4·5H2O的質量是0.01mol×250g/mol=2.5g.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2011-2012學年安徽省六安三中高一上學期期末考試化學試卷(帶解析) 題型:填空題
(1)0.7 mol H2O的質量為____________,其中含有_________個水分子,氫原子的物質的量為__________。
(2)質量相同的H2、NH3、SO2、O3四種氣體中,含有分子數目最少的是_________,在相同溫度和相同壓強條件下,體積最大的是___________。
(3)在_______mL 0.2 mo1·L-1 NaOH溶液(密度為1 g·cm-3)中含1g溶質;配制50mL0.2 mo1·L-1 CuSO4溶液,需要CuSO4·5H2O__________g。
查看答案和解析>>
科目:高中化學 來源:2015屆云南省高一下學期期末考試化學試卷(解析版) 題型:填空題
(1)0.7 mol H2O的質量為____________,其中含有_________個水分子,氫原子的物質的量為__________。
(2)質量相同的H2、NH3、SO2、O3四種氣體中,含有分子數目最少的是_________,在相同溫度和相同壓強條件下,體積最大的是___________。
(3)在_______mL 0.2 mo1·L-1 NaOH溶液(密度為1 g·cm-3)中含1g溶質;配制50mL0.2 mo1·L-1 CuSO4溶液,需要CuSO4·5H2O__________g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com