
【題目】 高純硫酸錳作為合成鎳鈷錳三元正極材料的原料,工業上可由天然二氧化錳粉與硫化錳礦(還含Fe、Al、Mg、Zn、Ni、Si等元素)制備,工藝如下圖所示。回答下列問題:
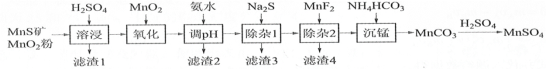
相關金屬離子[c0(Mn+)=0.1 mol·L1]形成氫氧化物沉淀的pH范圍如下:
金屬離子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
開始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“濾渣1”含有S和________________;寫出“溶浸”中二氧化錳與硫化錳反應的化學方程式_______。
(2)“氧化”中添加適量的MnO2的作用是將________________________。
(3)“調pH”除鐵和鋁,溶液的pH范圍應調節為_______~6之間。
(4)“除雜1”的目的是除去Zn2+和Ni2+,“濾渣3”的主要成分是______________。
(5)“除雜2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度過高,Mg2+沉淀不完全,原因是______
(6)寫出“沉錳”的離子方程式_____________________________________。
【答案】SiO2(不溶性硅酸鹽) MnO2+MnS+2H2SO4=2MnSO4+S+2H2O 將Fe2+氧化為Fe3+ 4.7 NiS和ZnS F與H+結合形成弱電解質HF,MgF2(s)Mg2++2F平衡向右移動 Mn2++2![]() =MnCO3↓+CO2↑+H2O
=MnCO3↓+CO2↑+H2O
【解析】
硫化錳礦(還含Fe、Al、Mg、Zn、Ni、Si等元素),MnS礦和MnO2粉加入稀硫酸,MnO2具有氧化性,二者發生氧化還原反應生成MnSO4、S,同時溶液中還有難溶性的SiO2及難溶性的硅酸鹽,所以得到的濾渣1為SiO2和S和難溶性的硅酸鹽;然后向濾液中加入MnO2,將還原性離子Fe2+氧化生成Fe3+,再向溶液中加入氨水調節溶液的pH除鐵和鋁,所以濾渣2為Fe(OH)3、Al(OH)3;根據流程圖,結合表格數據,加入的Na2S和Zn2+、Ni2+反應生成硫化物沉淀,“除雜1”的目的是除去Zn2+和Ni2+,所以濾渣3為NiS和ZnS;“除雜2”的目的是生成MgF2沉淀除去Mg2+,所以濾渣4為MgF2,最后向濾液中加入碳酸氫銨得到MnCO3沉淀,用稀硫酸溶解沉淀MnCO3得到硫酸錳,據此分析解答。
(1)根據上述分析,“濾渣1”含有S和難溶性的二氧化硅或硅酸鹽;“溶浸”中二氧化錳與硫化錳發生氧化還原反應生成錳離子、S和水,離子方程式為MnO2+MnS+2H2SO4=2MnSO4+S+2H2O,故答案為:SiO2(不溶性硅酸鹽);MnO2+MnS+2H2SO4=2MnSO4+S+2H2O;
(2)MnO2具有氧化性,能氧化還原性離子Fe2+生成Fe3+,從而在調節pH時除去這兩種離子,故答案為:將Fe2+氧化為Fe3+;
(3)“調pH”除鐵和鋁,溶液的pH應該大于這兩種離子完全沉淀所需pH且小于其它離子生成沉淀的pH值,在pH=4.7時Fe3+和Al3+沉淀完全,在pH=6.2時Zn2+開始產生沉淀,為了只得到氫氧化鋁和氫氧化鐵沉淀,需要溶液的pH范圍為4.7~6之間,故答案為:4.7;
(4)“除雜1”的目的是除去Zn2+和Ni2+,這兩種離子和硫離子生成硫化物沉淀,所以濾渣3為NiS和ZnS,故答案為:NiS和ZnS;
(5)“除雜2”的目的是生成MgF2沉淀除去Mg2+,溶液中存在MgF2的溶解平衡,如果溶液酸性較強,生成弱電解質HF而促進氟化鎂溶解,即F-與H+結合形成弱電解質HF,MgF2(s)Mg2++2F-平衡向右移動,所以鎂離子沉淀不完全,故答案為:F-與H+結合形成弱電解質HF,MgF2(s)Mg2++2F-平衡向右移動;
(6)“沉錳”時錳離子和碳酸氫根離子反應生成碳酸錳沉淀,同時還生成水、二氧化碳,離子方程式為Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案為:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O。


科目:高中化學 來源: 題型:
【題目】元素的價類二維圖是我們學習元素及其化合物相關知識的重要模型和工具,它指的是以元素的化合價為縱坐標,以物質的類別為橫坐標所繪制的二維平面圖像。下圖為鐵元素的價類二維圖,其中的箭頭 表示部分物質間的轉化關系,下列說法正確的是( )
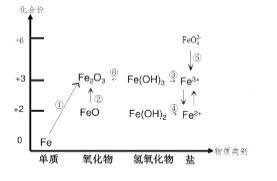
A. 鐵與高溫水蒸氣的反應可實現上述轉化①
B. FeO 是一種黑色粉末,不穩定,在空氣中受熱,迅速發生轉化②生成紅棕色粉末
C. 由圖可預測:高鐵酸鹽( FeO42- )具有強氧化性,可用于消毒。FeO42- 與水反應最終可生成 Fe(OH)3膠體,從而吸附水中的懸浮物,故高鐵酸鹽可用做凈水劑
D. 加熱 Fe(OH)3 發生轉化⑥,加水溶解可實現轉化③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用鹽酸的質量分數為36.5%,密度為1.20 g·mL-1。
(1)此濃鹽酸中HCl的物質的量濃度是________。
(2)配制100 mL該濃鹽酸,需要標準狀況下HCl的體積為________。
(3)配制100 mL 3.00 mol·L-1的鹽酸,需以上濃鹽酸的體積為________。
(4)將10.0 mL 3.00 mol·L-1的鹽酸與10.0 mL 1.00 mol·L-1的MgCl2溶液混合,則混合溶液中Cl-的物質的量濃度是________。(設混合后溶液的體積不變)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:X、Y、Z是三種常見元素,X原子核內只有一個質子,Y原子的最外層電子數是次外層的三倍,且X、Y、Z均能形成中學常見的雙原子氣體單質,并有如下轉化關系:
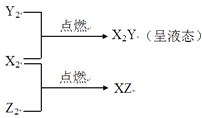
請回答下列問題:
(1)寫出Y2的化學式____________。
(2)X2分別在Y2、Z2中點燃時火焰的顏色是________、_________。
(3)Z2與X2Y反應生成兩種酸,其化學方程式為 ___________________。
(4)Z2與NaOH溶液反應的化學方程式為________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】漂白粉的主要成分是次氯酸鈣和氯化鈣。請回答下列問題:
(1)漂白粉長期露置在空氣中會變質,寫出漂白粉變質過程中涉及的化學方程式(若涉及氧化還原反應,請標注電子轉移情況):____________________________。
(2)某化學小組將完全變質后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到標準狀況下448mL氣體,則該漂白粉中所含有效成份的質量為_____________(假設漂白粉中的其它成份不與硝酸反應)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的Cu2S投入到足量濃硝酸中,收集到氣體nmol,向反應后的溶液(存在Cu2+和SO42-)中加入足量NaOH,產生藍色沉淀,過濾、洗滌、灼燒,得到CuO48.0g,若上述氣體為NO和NO2混合物,且體積比為1:2。則n為( )
A.3.28B.1.80C.0.80D.1.63
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈉與水反應后滴加酚酞,酚酞先變紅后褪色。某小組欲探究其原因,進行以下實驗:①取反應后溶液加入二氧化錳后迅速產生大量氣體;實驗②、③中紅色均不褪去。下列分析錯誤的是

A. 過氧化鈉與水反應產生的氣體為O2
B. 過氧化鈉與水反應需要MnO2作催化劑
C. 實驗②、③證明使酚酞褪色的不是氫氧化鈉和氧氣
D. 過氧化鈉與水反應可能生成了具有漂白性的H2O2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A為淡黃色固體,R是地殼中含量最多的金屬元素的單質,T為生活中使用最廣泛的金屬單質,D 是具有磁性的黑色晶體,C、F是無色無味的氣體,H是白色沉淀,W溶液中滴加KSCN溶液出現紅色。
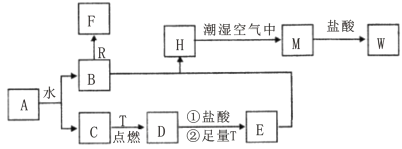
(1)物質D的化學式為___________,E化學式為___________。
(2)點燃氣體F前必須先___________________________。
(3)H在潮濕空氣中變成M的實驗現象是______________________________________________,化學方程式為_________________________________。
(4)B和R在溶液中反應生成F的離子方程式為___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把鎂條投入盛有鹽酸的敞口容器中,產生氫氣的速率變化曲線如圖所示。下列因素中,影響該反應速率的主要因素是

①鹽酸的濃度 ②鎂條的表面積 ③溶液的溫度 ④Cl-的濃度
A. ①④ B. ③④ C. ①③ D. ②③
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com