
在給定的條件下,下列選項所示的物質間轉化均能實現的是
A. H2SiO3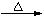 SiO2
SiO2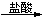 SiCl4 B. 濃HCl
SiCl4 B. 濃HCl Cl2
Cl2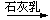 漂白粉
漂白粉
C. Fe Fe2O3
Fe2O3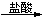 FeCl3 D. Mg(OH)2
FeCl3 D. Mg(OH)2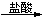 MgCl2(aq)
MgCl2(aq)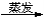 無水MgCl2
無水MgCl2
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2017屆江西省、臨川一中高三1月聯考理綜化學試卷(解析版) 題型:選擇題
下列實驗現象預測、實驗設計、儀器使用能達到目的是( )
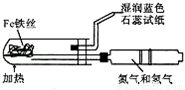
A. 模擬工業制氨氣并檢驗產物
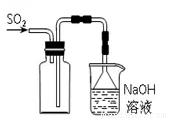
B. 實驗室采用所示裝置收集SO2
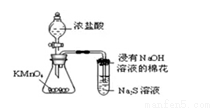
C. 可用所示裝置比較KMnO4、Cl2、S的氧化性強弱
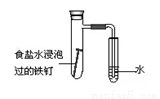
D. 可用所示裝置驗證鐵發生析氫腐蝕
查看答案和解析>>
科目:高中化學 來源:2017屆浙江省臺州市高三上學期期末質量評估考試化學試卷(解析版) 題型:選擇題
氫氧燃料電池是一種化學電源,如圖所示,以石墨為電極,兩極分別通入氫氣和氧氣,KOH溶液為電解質溶液,下列說法不正確的是

A. a電極是該電池的正極
B. 電池工作時,電子從a電極流出經導線流向b電極
C. 工作一段時間后,電解質溶液堿性減弱
D. b極的電極反應式為:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三下學期開學考試化學試卷(解析版) 題型:簡答題
銅元素的化合物種類很多,我們可以利用所學物質結構與性質的相關知識去認識和理解它們。
(1)CuSO4和Cu(NO3)2是自然界中重要的銅鹽。
① CuSO4和Cu(NO3)2中陽離子的基態外圍電子排布式為_______________。
② S、O、N三種元素的第一電離能由大到小為_____________。
③ CuSO4的熔點為560℃,Cu(NO3)2的熔點為115℃,CuSO4熔點更高的原因是________。
(2)硫酸銅溶液中滴入氨基乙酸鈉(H2NCH2COONa)即可得到配合物A,其結構如圖所示。請回答下列問題:
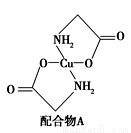
① 配合物A中N原子的軌道雜化類型為__________。
② 1 mol配合物A含有σ鍵的數目為_____________。
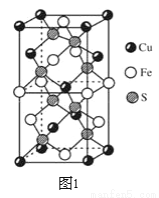
(3)CuFeS2的晶胞如圖1所示,CuFeS2的晶胞中每個Cu原子與__個S原子相連
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三下學期開學考試化學試卷(解析版) 題型:選擇題
常溫下,向10mL0.1mol·L-1H2A溶液中逐滴加入0.1mol·L-1NaOH溶液。有關微粒的物質的量變化如圖(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根據圖示分析判斷,下列微粒濃度大小關系正確的是
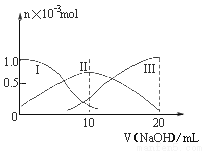
A. 當v=0時,c(H+)=c(OH-)+c(HA-)+c(A2-)
B. 當v=10時,c(Na+)=c(H2A)+c(HA-)+c(A2-)
C. 當v=20時,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 當pH=7時,c(Na+)>c(HA-)+ c(A2-)
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省高三下學期開學考試化學試卷(解析版) 題型:選擇題
W、X、Y、Z均為的短周期元素,原子序數依次增加,W的原子核外最外層電子數是次外層的2倍,X-、Y+具有相同的電子層結構,Z的陰離子不能發生水解反應。下列說法正確的是
A. 原子半徑:Y>Z>X>W
B. 簡單氫化物的熔沸點:Z>X>W
C. X與Y兩種元素組成的化合物是離子化合物
D. 最高價氧化物的水化物的酸性:W <Z<X
查看答案和解析>>
科目:高中化學 來源:2017屆福建省漳州市八校高三2月聯考化學試卷(解析版) 題型:簡答題
X、Y、Z、W為四種短周期元素,其中Y元素原子核外最外層電子數是其電子層數的3倍,它們在周期表中的相對位置如下圖所示:
X | Y | |
Z | W |
請回答下列問題:
(1)W位于周期表中第__________周期,第____族;
(2)X可形成雙原子分子,其分子的電子式是_____;Y和氫元素形成的10電子微粒中常見+1價陽離子為_____(填化學式,下同);Z和氫元素形成的18電子微粒中常見的-1價陰離子為______;
(3)工業上將干燥的W單質通入熔融的Z單質中可制得化合物Z2W2,該物質可與水反應生成一種能使品紅溶液褪色的氣體,0.2mol該物質參加反應時轉移0.3mol電子,其中只有一種元素化合價發生改變,寫出Z2W2與水反應的化學方程式______________________。
(4)在一定條件下,由元素Y和Z組成的一種氣態化合物可發生催化氧化反應,反應達平衡時有三種氣態物質共存,已知每轉移4mol電子放熱190.0kJ,該反應的熱化學方程式是_____________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江蘇省淮安市高一上學期期末調研測試化學試卷(解析版) 題型:簡答題
從鋁土礦(主要成分為Al2O3,還有少量雜質)中提取鋁的工藝流程及步驟如下:
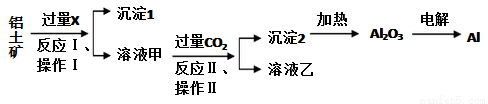
試回答下列問題:
(1)試劑X為__________;
(2)操作Ⅰ、操作Ⅱ均為_____________(填操作名稱),在實驗室進行該操作時需要的玻璃儀器有_______________;
(3)金屬鋁與氧化鐵混合在高溫下,會發生劇烈的反應,該反應的化學方程式為_________________,請舉一例該反應的用途_________________;
(4)反應Ⅱ的離子方程式為_______________________;
(5)電解熔融氧化鋁制取金屬鋁,若有0.6 mol電子發生轉移,理論上能得到金屬鋁的質量是________g。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省菏澤市高一上學期期末考試(B卷)化學試卷(解析版) 題型:選擇題
下列實驗“操作和現象”與“結論”對應關系正確的是( )
選項 | 實驗操作及現象 | 實驗結論 |
A | 向某溶液中加入氯化鋇溶液,有白色沉淀生成,再加鹽酸酸化,沉淀不溶解 | 該溶液中一定含有SO42- |
B | 向某溶液中同時加入幾滴KSCN溶液和少量新制的氯水,溶液變為紅色 | 該溶液中一定含有Fe2+ |
C | 向某溶液中加入稀鹽酸,產生能使澄清石灰水變渾濁的無色氣體 | 該溶液中一定含有CO32- |
D | 向某溶液加入NaOH并微熱,產生能夠使濕潤的紅色石蕊試紙變藍的無色氣體 | 該溶液中一定含有NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com