
10分)(1)某溫度(t ℃)時,水得到KW=10-13,則該溫度______25℃,(填“<”“>”或“=”),將此溫度下pH=1的硫酸溶液aL與pH=12的氫氧化鈉溶液bL混合。若所得混合液為中性,則a:b= ;
(2)下列溶液,c(H+)由小到大的排列順序是_________,pH由小到大排列順序是________;(填序號) ①0.1 mol/LHCl溶液 ②0.1 mol/LH2SO4溶液 ③0.1 mol/LNaOH溶液
④0.1 mol/LCH3COOH溶液
(3)對于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
 -C2H5)可生產塑料單體苯乙烯(
-C2H5)可生產塑料單體苯乙烯( -CH=CH2),其原理反應是:
-CH=CH2),其原理反應是: -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某溫度下,將0.40mol
-CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某溫度下,將0.40mol  -C2H5(g)充入2L真空密閉容器中發生反應,測定該容器內的物質,得到數據如下表:
-C2H5(g)充入2L真空密閉容器中發生反應,測定該容器內的物質,得到數據如下表: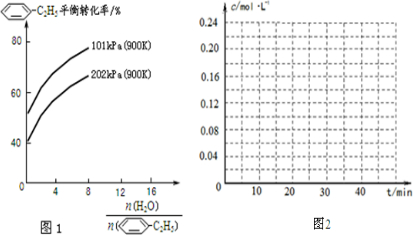
| 時間/min | 0 | 10 | 20 | 30 | 40 |
n( -C2H5)/mol -C2H5)/mol |
0.40 | 0.30 | 0.26 | n2 | n3 |
n( -CH=CH2)/mol -CH=CH2)/mol |
0.00 | 0.10 | n1 | 0.16 | 0.16 |
 -C2H5(g)的平衡轉化率與水蒸氣的用量、體系總壓強的關系如圖1所示.當其它條件不變時,水蒸氣的用量越大,平衡轉化率將
-C2H5(g)的平衡轉化率與水蒸氣的用量、體系總壓強的關系如圖1所示.當其它條件不變時,水蒸氣的用量越大,平衡轉化率將 -CH=CH2(g)和H2(g),假設在40min時達到上述同樣的平衡狀態,請在圖2中畫出并標明該條件下
-CH=CH2(g)和H2(g),假設在40min時達到上述同樣的平衡狀態,請在圖2中畫出并標明該條件下  -C2H5(g)和
-C2H5(g)和 -CH=CH2(g)的濃度c隨時間t變化的曲線
-CH=CH2(g)的濃度c隨時間t變化的曲線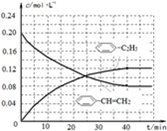

查看答案和解析>>
科目:高中化學 來源:2012屆福建省薌城三校高三下學期第二次考試化學試卷(帶解析) 題型:填空題
(共10分)
(1)已知可逆反應:M(g)+N(g) P(g)+Q(g);△H>0,請回答下列問題:
P(g)+Q(g);△H>0,請回答下列問題:
①若要增大M的轉化率,在其它條件不變的情況下可以采取的措施為_______________。
| A.加入一定量M | B.加入一定量N |
| C.反應溫度升高 | D.縮小容器體積 |

查看答案和解析>>
科目:高中化學 來源:2014屆重慶市高二上學期期中考試化學試卷(解析版) 題型:填空題
(12分) (1)某溫度下,Kw=10-12。
①若保持溫度不變,某溶液中c(H+)為1×10-7mol·L-1,則該溶液顯 性(填“酸”、“堿”或“中”)。
②若保持溫度不變,向水中通入的HCl氣體恰好使溶液中c(H+)/c(OH-)=1010,則此時水電離的c(H+)= mol·L-1。
(2)常溫下,如果取0.1mol/LHA溶液與0.1mol/LNaOH溶液等體積混合(忽略混合后溶液體積的變化),測得混合溶液的pH=8,試回答以下問題:
①混合溶液的pH=8的原因(用離子方程式表示): 。
②混合溶液中離子濃度由大到小的順序是: 。
③混合溶液中由水電離出的c(H+) 同濃度NaOH溶液中由水電離出的c(H+)
(填“>”、“<”或“=”)。
④求出混合溶液中下列算式的精確計算結果(填具體數據):
c(Na+)-c(A-)= mol/L。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年福建省薌城三校高三下學期第二次考試化學試卷(解析版) 題型:填空題
(共10分)
(1)已知可逆反應:M(g)+N(g) P(g)+Q(g);△H>0,請回答下列問題:
P(g)+Q(g);△H>0,請回答下列問題:
①若要增大M的轉化率,在其它條件不變的情況下可以采取的措施為_______________。
A.加入一定量M B.加入一定量N C.反應溫度升高
D.縮小容器體積 E.加入某物質作催化劑 F.分離出一定量P
②在某溫度下,反應物的起始濃度分別為:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1,達到平衡后,M的轉化率為60%,此時N的轉化率為_______________。此反應的化學平衡常數K=_______________。
③若反應溫度不變,反應物的起始濃度分別為:c(M)= 4 mol·L-1,c(N)=a mol·L-1;達到平衡后,c(P)=2 mol·L-1,a=_______________mol·L-1。
(2)隨著科學技術的進步,人們研制出了多種類型的甲醇質子交換膜燃料電池,以滿足不同的需求。
下圖是某筆記本電腦用甲醇質子交換膜燃料電池的結構示意圖。甲醇在催化劑作用下提供質子和電子(電子轉移的方向如下圖所示),電子經外電路、質子經內電路到達另一極與氧氣反應,電池總反應為:2CH3OH+3O2===2CO2+4H2O。則c電極是 (填“正極”或“負極”),c電極上發生的電極反應式為_____________________________________________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com