
分析 (1)①根據鎂為+2價及其化合物的化合價代數和為0計算MgH2中氫元素的化合價;
②根據混合物X(17MgH2+12Al)與足量的NaOH溶液混合,鋁與氫氧化鈉反應還可以生成氫氣,據此計算;
(2)從加快反應速率的因素分析,一是鋁、汞及介質共同形成了微小原電池,加速了鋁的氧化反應;二是汞作催化劑加速了鋁的氧化反應;用汞和除去氧化膜的鋁片在干燥的空氣中作對比實驗,如果鋁片表面會迅速長出胡須狀的“白毛”,則為鋁、汞及介質共同形成了微小原電池,加速了鋁的氧化反應,反之則不是,據此分析;
(3)根據工業上可用Al2O3、Cl2、焦炭混合反應制備無水AlCl3,該反應的另一種產物是可燃性氣體根據原子守恒則為CO書寫方程式;
(4)①依據三價鐵、三價鋁離子在水中發生水解生成氫氧化鐵和氫氧化鋁的膠體吸附水中懸浮雜質來凈水分析;
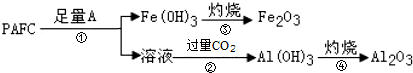
②為檢測PAFC中Al和Fe含量,PAFC加入足量A為氫氧化鈉溶液反應生成氫氧化鐵沉淀和偏鋁酸鈉溶液過濾后得到氫氧化鐵灼燒得到氧化鐵,濾液中通入過量二氧化碳氣體分壓生成氫氧化鋁沉淀,灼燒得到氧化鋁;試劑A為氫氧化鈉溶液;步驟②中的反應為偏鋁酸鈉溶液中通入過量二氧化碳氣體生成氫氧化鋁沉淀;
解答 解:(1)①因為鎂為+2價,又化合物的化合價代數和為0,所以MgH2中氫元素的化合價為-1價,故答案為:-1;
②混合物X(17MgH2+12Al)與足量的NaOH溶液混合,鋁與氫氧化鈉反應還生成氫氣,其方程式為:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,又766gX中含鋁的物質的量為$\frac{766}{17×26+12×27}$×12mol=12mol,所以生成氫氣為$\frac{12}{2}$×3mol=18mol,又766gX中含MgH2的物質的量為$\frac{766}{17×26+12×27}$×17mol=17mol,所以一共可以達到(18+17)=35molH2,故答案為:35;
(2)因為加快反應速率,一是鋁、汞及介質共同形成了微小原電池,加速了鋁的氧化反應;二是汞作催化劑加速了鋁的氧化反應;用汞和除去氧化膜的鋁片在干燥的空氣中作對比實驗,如果鋁片表面會迅速長出胡須狀的“白毛”,則為鋁、汞及介質共同形成了微小原電池,加速了鋁的氧化反應,反之則不是,故答案為:汞作催化劑加速了鋁的氧化反應;用汞和除去氧化膜的鋁片在干燥的空氣中作對比實驗;
(3)因為工業上可用Al2O3、Cl2、焦炭混合反應制備無水AlCl3,該反應的另一種產物是可燃性氣體根據原子守恒則為CO,所以方程式為Al2O3+3Cl2+3C═2AlCl3+3CO;故答案為:Al2O3+3Cl2+3C═2AlCl3+3CO;
(4)①因為三價鐵、三價鋁離子在水中發生水解生成氫氧化鐵和氫氧化鋁的膠體吸附水中懸浮雜質來凈水,又強酸性和強堿性溶液中三價鐵、三價鋁離子無法發生水解生成相應膠體,所以均會失去凈水作用;
故答案為:強酸性和強堿性溶液中三價鐵、三價鋁離子無法形成相應膠體;
②為檢測PAFC中Al和Fe含量,PAFC加入足量A為氫氧化鈉溶液反應生成氫氧化鐵沉淀和偏鋁酸鈉溶液過濾后得到氫氧化鐵灼燒得到氧化鐵,濾液中通入過量二氧化碳氣體分壓生成氫氧化鋁沉淀,灼燒得到氧化鋁;所以試劑A為氫氧化鈉溶液,步驟②中的反應為偏鋁酸鈉溶液中通入過量二氧化碳氣體生成氫氧化鋁沉淀,反應的離子方程式為:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案為:氫氧化鈉溶液,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
點評 本題考查了鋁及其化合物在生產、生活中有極其廣泛的用途,主要是物質性質的理解應用,難度(4)掌握流程分析方法和物質性質是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
| 操作1:準確稱取一定質量的膽礬晶體并用適量蒸餾水溶解. 操作2:將所得溶液轉移到儀器X中,用蒸餾水沖洗燒杯和玻璃棒2~3次,將洗滌液也轉移到X中. 操作3:繼續向X中加蒸餾水至液面 離X的刻度線l~2cm處. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 .有機物
.有機物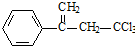 是選擇性內吸傳導性除草劑,俗稱稗草烯,主要用于水稻田防除稗草,溫度和濕度對藥效影響大,溫度高、濕度大藥效發揮快.下列有關該有機物的說法不正確的是( )
是選擇性內吸傳導性除草劑,俗稱稗草烯,主要用于水稻田防除稗草,溫度和濕度對藥效影響大,溫度高、濕度大藥效發揮快.下列有關該有機物的說法不正確的是( )| A. | 屬于鹵代烴,能使酸性高錳酸鉀溶液和溴水褪色 | |
| B. | 該物質既有對映異構,也有順反異構 | |
| C. | 在堿性條件下充分水解,可生成羧酸鹽 | |
| D. | 1mol 該物質在一定條件下可與4molH2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
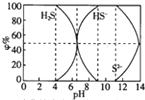 25℃時0.1mol/L的硫化鈉含S組份φ%(以物質的量計算)分布如圖如下,下列結論正確的是( )
25℃時0.1mol/L的硫化鈉含S組份φ%(以物質的量計算)分布如圖如下,下列結論正確的是( )| A. | 當c(HS-)>c(S2-)時,溶液一定顯酸性 | |
| B. | 當pH=7時,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 當4<pH時,向其中滴加0.1mol/LCuSO4都有CuS沉淀(Ksp(CuS)=6.3×10-36) | |
| D. | 當pH=9時,溶液中有c(H+)=c(OH-)+c(HS-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有H、D、T與16O、17O、18O構成的過氧化氫分子的相對分子質量有36個 | |
| B. | H2、D2、T2互為同素異形體 | |
| C. | H2、D2、T2在相同條件下的密度比為1:2:3 | |
| D. | 氕、氘發生核聚變成其他元素,屬于化學變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. 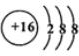 ;D與E能形成一種所有原子最外層均滿足8電子的分子,該分子的結構式為S=C=S;D所在族元素的氫化物中,沸點最低的是H2S.
;D與E能形成一種所有原子最外層均滿足8電子的分子,該分子的結構式為S=C=S;D所在族元素的氫化物中,沸點最低的是H2S.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
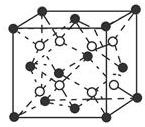 有A、B、C、D、E五種原子序數依次增大的元素(原子序數均小于30).A的基態原子2p能級有3個單電子;C的基態原子2p能級有1個單電子;E原子最外層有1個單電子,其次外層有3個能級且均排滿電子;D與E同周期,價電子數為2.則:
有A、B、C、D、E五種原子序數依次增大的元素(原子序數均小于30).A的基態原子2p能級有3個單電子;C的基態原子2p能級有1個單電子;E原子最外層有1個單電子,其次外層有3個能級且均排滿電子;D與E同周期,價電子數為2.則:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com