
【題目】氨基酸微量元素螯合物在飼料生產應用、解決過量添加無機鹽造成環境污染等方面有重要應用。該類螯合物通常以蛋氨酸、賴氨酸、甘氨酸等為配位體,以銅、鐵、鋅、錳、鉻、鈷等元素為中心離子。
(1)甘氨酸中共有_____個σ鍵,所含元素的電負性由大到小的順序為______,官能團中C原子的雜化方式為_______。
(2)上述金屬元素中,基態原子有五個未成對電子的原子的核外電子排布式為______。
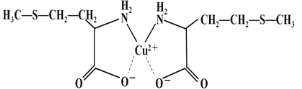
(3)蛋氨酸銅的結構式如下圖。該螯合物中含有的化學鍵類型有_________(填序號)。
a.配位鍵 b.極性鍵 c.離子鍵 d.非極性鍵
(4)Cr是周期表中第ⅥB族元素,化合價可以是0~+6的整數價態。某化合物的化學式為Na3CrO8,其陰離子結構可表示為![]() ,則Cr的化合價為______。
,則Cr的化合價為______。![]() 呈四面體構型,結構為
呈四面體構型,結構為![]() ,
,![]() 由兩個
由兩個![]() 四面體組成,這兩個
四面體組成,這兩個![]() 四面體通過共用一個頂角氧原子彼此連接,結構為
四面體通過共用一個頂角氧原子彼此連接,結構為![]() 。則由n(n>1)個
。則由n(n>1)個![]() 通過頂角氧原子連結的鏈式結構的化學式為____。
通過頂角氧原子連結的鏈式結構的化學式為____。
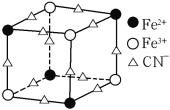
(5)實驗室中可用KSCN或K4[Fe(CN)6]來檢驗Fe3+。FeCl3 與KSCN溶液混合,可得到配位數為5的配合物的化學式是____;K4[Fe(CN)6]與Fe3+反應可得到一種藍色沉淀KFe[Fe(CN)6],該物質晶胞的![]() 結構如下圖所示(K+未畫出),則一個晶胞中的K+個數為____。
結構如下圖所示(K+未畫出),則一個晶胞中的K+個數為____。
【答案】9 O>N>C>H sp2 [Ar]3d54s2 abcd +5 ![]() K2[Fe(SCN)5] 4
K2[Fe(SCN)5] 4
【解析】
(1)甘氨酸的結構為: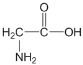 ,1個單鍵含有1個σ鍵,一個雙鍵含有1個σ鍵和1個π鍵;元素的非金屬性越強,其電負性越強;官能團是羧基;
,1個單鍵含有1個σ鍵,一個雙鍵含有1個σ鍵和1個π鍵;元素的非金屬性越強,其電負性越強;官能團是羧基;
(2)基態原子有五個未成對電子的原子是Mn;
(3) Cu2+與N原子形成配位鍵,相同原子之間形成非極性鍵、不同原子之間形成極性鍵,Cu2+與COO-形成離子鍵;
(4)從陰離子結構可以判斷Cr的化合價為+5價。由n(n>1)個![]() 通過共用一個頂角氧原子彼此連接的鏈式結構,根據連接規律,推斷其通式為
通過共用一個頂角氧原子彼此連接的鏈式結構,根據連接規律,推斷其通式為![]() ;
;
(5)Fe3+與SCN-形成配位數為5的配離子為![]() ,根據電荷守恒可知與K+形成的配合物化學式;利用均攤法計算晶胞的
,根據電荷守恒可知與K+形成的配合物化學式;利用均攤法計算晶胞的![]() 結構中Fe3+、Fe2+、CN-數目,結合電荷守恒計算K+數目,進而計算一個晶胞中的K+個數;
結構中Fe3+、Fe2+、CN-數目,結合電荷守恒計算K+數目,進而計算一個晶胞中的K+個數;
(1) 甘氨酸的結構為: ,1個甘氨酸分子中含有σ鍵的數目為9;元素的非金屬性越強,其電負性越強,四種非金屬元素的電負性從大到小的順序是:O>N>C>H;官能團是羧基,羧基上C原子價層電子對個數是3,根據價層電子對互斥理論,雜化類型是sp2,故答案為:9;O>N>C>H;sp2;
,1個甘氨酸分子中含有σ鍵的數目為9;元素的非金屬性越強,其電負性越強,四種非金屬元素的電負性從大到小的順序是:O>N>C>H;官能團是羧基,羧基上C原子價層電子對個數是3,根據價層電子對互斥理論,雜化類型是sp2,故答案為:9;O>N>C>H;sp2;
(2)基態原子有五個未成對電子的原子是Mn,核外電子排布式為:[Ar]3d54s2,故答案為:[Ar]3d54s2;
(3) Cu2+與N原子形成配位鍵,C-C之間形成非極性鍵,C-H、C-S之間形成極性鍵,Cu2+與COO-形成離子鍵,故答案為:abcd;
(4) 由陰離子結構可知,Cr與O中形成5個價鍵,共用電子對偏向O,則Cr的化合價為+5價,兩個![]() 每共用一個角頂氧原子,就少一個氧原子,所以由n(n>1)個
每共用一個角頂氧原子,就少一個氧原子,所以由n(n>1)個![]() 通過角頂氧原子連續的鏈式,減少(n-1)個氧原子,微粒電荷不變,則由n(n>1)個
通過角頂氧原子連續的鏈式,減少(n-1)個氧原子,微粒電荷不變,則由n(n>1)個![]() 通過角頂氧原子連續的鏈式結構的化學式為
通過角頂氧原子連續的鏈式結構的化學式為![]() ,故答案為:+5;
,故答案為:+5;![]() ;
;
(5) Fe3+與SCN-形成配位數為5的配離子為![]() ,根據電荷守恒可知與K+形成的配合物化學式為K2[Fe(SCN)5];晶胞的
,根據電荷守恒可知與K+形成的配合物化學式為K2[Fe(SCN)5];晶胞的![]() 結構中,Fe3+離子的個數為:
結構中,Fe3+離子的個數為:![]() ,Fe2+離子的個數為:
,Fe2+離子的個數為:![]() ,CN-離子的個數為:
,CN-離子的個數為:![]() ,根據電荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),可得N(K+)=
,根據電荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),可得N(K+)=![]() ,故一個晶胞中的K+個數=
,故一個晶胞中的K+個數=![]() ,故答案為:K2[Fe(SCN)5];4。
,故答案為:K2[Fe(SCN)5];4。


 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 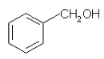 與
與![]() 含有相同的官能團,互為同系物
含有相同的官能團,互為同系物
B. 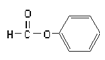 屬于醛類,官能團為-CHO
屬于醛類,官能團為-CHO
C. ![]() 的名稱為:2-乙基-1-丁烯
的名稱為:2-乙基-1-丁烯
D. ![]() 的名稱為:2-甲基-1,3-二丁烯
的名稱為:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有7種短周期元素的原子序數按A、B、C、D、E、F、G 的順序依次增大;B元素一種原子的含量常用于判定古生物遺體的年代,A和C元素的原子能形成4核10電子的微粒;D和E可形成離子化合物E2D,E2D中所有微粒的電子數相同,且電子總數為30;E、F、G的最高價氧化物對應的水化物之間可以相互反應;G和D同主族。試回答下列問題:
(1)C元素的原子結構示意圖________________。
(2)A和D可形成化合物的化學式為______________。
(3)B元素在周期表中的位置為________________;過量的B元素的最高價氧化物與氫氧化鈉溶液反應的離子方程式為__________________。
(4)D、E、F、G的離子半徑由大到小順序為(用離子符號表示)______________________。
(5)F的單質與E元素的最高價氧化物對應的水化物反應的離子方程式為__________________。
(6)上述元素形成的二元化合物中,能夠用于漂白的氣體物質中含有的化學鍵類型為__________,能夠用于漂白的固體物質中陰、陽離子個數比為____________。
(7)寫出D元素原子形成的10電子微粒X與G元素原子形成的18電子微粒Y反應的離子方程式:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用反應6NO2+8NH3=7N2+12H2O構成電池的方法,既能實現有效除氮氧化物的排放,減輕環境污染,又能充分利用化學能,裝置如圖所示,回答問題:
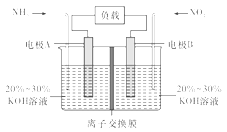
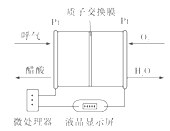
(1)電流從____(選填“左”或“右”,下同)側電極經過負載后流向______側電極。
(2)為使電池持續放電,離子交換膜需選用______離子交換膜(選填“陰”或“陽”)。
(3)A電極上的電極反應式為___________________________。
(4)當有4.48 L NO2(標準狀況)被處理時,轉移電子為________摩爾。
(5)負載可以測定電流大小,從而確定氣體含量,酒駕測定工作原理與其相似。仔細閱讀圖:寫出陰極反應式:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知C—C鍵可以繞鍵軸自由旋轉,結構簡式為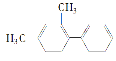 的烴,下列說法中不正確的是( )
的烴,下列說法中不正確的是( )
A.分子中至少有10個碳原子處于同一平面上
B.分子中至少有8個碳原子處于同一平面上
C.分子中至多有14個碳原子處于同一平面上
D.該烴不屬于苯的同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學反應與能量變化的說法正確的是
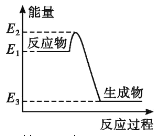
A. 如圖所示的化學反應中,反應物的鍵能之和大于生成物的鍵能之和
B. 相同條件下,氫氣和氧氣反應生成液態水比生成等量的氣態水放出的熱量少
C. 金剛石在一定條件下轉化成石墨能量變化如圖所示,熱反應方程式可為:C(s金剛石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同溫同壓下,H2(g)+C12(g)==2HCl(g)能量變化如圖所示,在光照和點燃條件下的△H相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯(C2H6)是石油化工行業重要的有機原料之一,主要用于生產聚丙烯、二氯丙烷、異丙醇等產品。
(1)丙烷脫氫制備丙烯。由圖可得C3H8(g)C3H6(g)+H2(g) H=____________kJ/mol
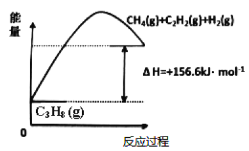
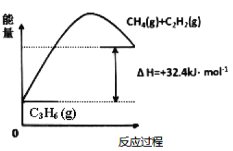
①為了同時提高反應速率和反應物的平衡轉化率,可采取的措施是________。
②目前在丙烷脫氫制丙烯時常通入適量的O2,讓其同時發生下列反應:2C3H8(g) +O2(g)2C3H6(g)+2H2O(g) H=-235kJ/mol,通入O2的目的是_______。
(2)以C4H8和C2H4為原料發生烯烴歧化反應C4H8(g)+C2H4(g)2C3H6(g) H>0
①某溫度下,上述反應中,正反應速率為v正=K正c(C4H8)c(C2H4)、逆反應速率為v逆=K逆c2(C3H6),其中K正、K逆為速率常數,該反應使用WO3/SiO2為催化劑,下列說法中正確的是_____________
A.催化劑參與了歧化反應,但不改變反應歷程
B.催化劑使K正和K逆增大相同的倍數
C.催化劑降低了烯烴歧化反應的活化能,增大了活化分子百分數
D.速率常數的大小與反應程度無關系
②已知t1min時達到平衡狀態,測得此時容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡時C3H6的體積分數為25%。再往容器內通入等物質的量的C4H8和C2H4,在新平衡中C3H6的體積分數___________25%(填“>”、“<”、“=”)。
(3)工業上可用丙烯加成法制備1,2-二氯丙烷(CH2ClCHClCH3),主要副產物為3-氯丙烯(CH2=CHCH2Cl),反應原理為:
Ⅰ. CH2=CHCH3(g)+Cl2(g)CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)
一定溫度下,向恒容密閉容器中充入等物質的量的CH2=CHCH3(g)和Cl2(g)。在催化劑作用下發生反應Ⅰ,容器內氣體的壓強隨時間的變化如表所示。
時間/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
壓強/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
①用單位時間內氣體分壓的變化來表示反應速率,即![]() ,則前120min內平均反應速率v(CH2ClCHClCH3)=____________kPamin-1。
,則前120min內平均反應速率v(CH2ClCHClCH3)=____________kPamin-1。
②該溫度下,若平衡時HCl的體積分數為12.5%,反應Ⅰ的平衡常數Kp=__________kPa-1(Kp為以分壓表示的平衡常數,保留小數點后2位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為室溫時不同pH下磷酸鈉鹽溶液中含磷微粒形態的分布,其中a、b、c三點對應的pH分別為2.12、7.21、12.66,其中δ表示含磷微粒的物質的量分數。下列說法正確的是
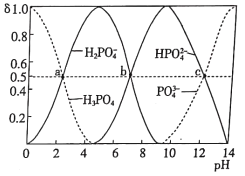
A.選擇酚酞作指示劑,用NaOH溶液滴加磷酸溶液的反應為H3PO4+3OH-=PO![]() +3H2O
+3H2O
B.室溫下,水電離的c(H+)·c(OH-):a<b<c
C.a、b、c點對應水溶液中c(H3PO4)+c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )之和相等
)之和相等
D.室溫下,H3PO4的第三級電離常數的數量級為10-12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯(C3H6)是石油化工行業重要的有機原料之一,主要用于生產聚丙烯、二氯乙烯、異丙烯等產品。
(1)丙烷脫氫制備丙烯。由圖可得C3H8(g)![]() C3H6(g)+H2(g) ΔH=___kJ/mol。
C3H6(g)+H2(g) ΔH=___kJ/mol。

①為了同時提高反應速率和反應物的平衡轉化率,可采取的措施是___。
②目前在丙烷脫氫制丙烯時常加入適量的O2,讓其同時發生下列反應:
2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
(2)以C4H8和C2H4為原料發生烯烴歧化反應C4H8+C2H4![]() 2C3H6(g) ΔH>0。
2C3H6(g) ΔH>0。
①某溫度下,上述反應中,正反應速率為v正=k正c(C4H8)c(C2H4)、逆反應速率為v逆=k逆c2(C3H6),其中k正、k逆為速率常數,該反應使用WO3/SiO2為催化劑,下列說法中正確的是___。
A.催化劑參與了歧化反應,但不改變反應歷程
B.催化劑使k正和k逆增大相同的倍數
C.催化劑降低了烯烴歧化反應的活化能,增大了活化分子百分數
D.速率常數的大小與反應歷程無關系
②已知t1min時達到平衡狀態,測得此時容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol且平衡時C3H6的體積分數為25%。再往容器內通入等物質的量的C4H8和C2H4,在新平衡中C3H6的體積分數___25%。(填“>”、“<”、“=”)
(3)工業上可用丙烯加成法制備1,2—二氯丙烷(CH2ClCHClCH3),主要副產物為3—氯乙烯(CH2=CHCH2Cl),反應原理為
Ⅰ.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g)
CH2ClCHClCH3(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
一定溫度下,向恒容密閉容器中充入等物質的量的CH2=CHCH3(g)和Cl2(g)。在催化劑作用下發生反應I、Ⅱ,容器內氣體的壓強隨時間的變化如下表所示。
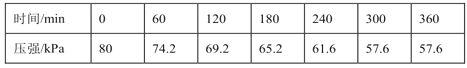
①用單位時間內氣體分壓的變化來表示反應速率,即v=![]() ,則前120min內平均反應速率v(CH2ClCHClCH3)=___kPamin-1。
,則前120min內平均反應速率v(CH2ClCHClCH3)=___kPamin-1。
②該溫度下,若平衡時HCl的體積分數為12.5%,反應Ⅰ的平衡常數Kp=__kPa-1。(Kp為以分壓表示的平衡常數,保留小數點后2位。)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com