
 ,化學平衡常數只與溫度有關,與物質的濃度無關,根據v=
,化學平衡常數只與溫度有關,與物質的濃度無關,根據v= 計算NO2的化學反應速率,再根據同一反應中、同一時間段內反應速率之比等于計量數之比計算v(N2O4).
計算NO2的化學反應速率,再根據同一反應中、同一時間段內反應速率之比等于計量數之比計算v(N2O4).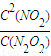 ,化學平衡常數只與溫度有關,與物質的濃度無關,所以平衡常數K不變,v(NO2)=
,化學平衡常數只與溫度有關,與物質的濃度無關,所以平衡常數K不變,v(NO2)=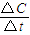 =
= =0.2mol/L.s,則v(N2O4)=
=0.2mol/L.s,則v(N2O4)= v(NO2)=0.1mol/L.s;
v(NO2)=0.1mol/L.s;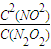 ,不變,0.1mol/L.s.
,不變,0.1mol/L.s.

 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:
| C2(NO2) |
| C(N2O2) |
| C2(NO2) |
| C(N2O2) |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| a |
| 200b |
| a |
| 200b |

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:山東 題型:問答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com