
【題目】下列反應所得產物一定不存在同分異構體的是
A. 異戊二烯與(![]() )等物質的量的Br2反應
)等物質的量的Br2反應
B. 2-氯丁烷與(![]() )NaOH乙醇溶液共熱
)NaOH乙醇溶液共熱
C. 甲苯與Cl2在一定條件下發生取代反應
D. 鄰羥基苯甲酸(![]() )與NaHCO3溶液反應
)與NaHCO3溶液反應
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】對水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解釋,說法正確的是
A. Mg(OH)2的溶度積大于MgCO3的溶度積,且在水中發生了沉淀轉化
B. Mg(OH)2比MgCO3更難溶,且在水中發生了沉淀轉化
C. MgCO3電離出的CO![]() 發生水解,使水中OH-濃度減小,對Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
發生水解,使水中OH-濃度減小,對Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D. 二者不能相互轉化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)已知:pOH=-lgc(OH-)。常溫下,某弱酸的鈉鹽(Na2XO3)溶液中微粒濃度的變化關系如下圖所示。下列說法正確的是

A. 溶液加水稀釋,![]() 先增大后不變
先增大后不變
B. 在NaHXO3溶液中:![]() >1
>1
C. 向Na2XO3溶液中滴加稀鹽酸至溶液顯中性時:c(Na+)+2c(H+)=c(HXO3-)+2c(XO32-)+2c(OH-)
D. 實線M表示pOH與![]() 的變化關系
的變化關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,下圖燒杯中各盛有40 mL的溶液。

(1)甲溶液pH=__________,水電離的c(OH-)=________mol/L。
(2)若分別取20 mL甲溶液和乙溶液充分混合,所得的混合溶液丙的pH=6,水電離的c(H+)=________mol/L;溶液中離子濃度大小順序是__________。
(3)若將剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液pH>7,該溶液中離子濃度大小順序是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組以重鉻酸鉀(K2Cr2O7)溶液為研究對象,結合所學反應原理的知識改變條件使其發生“色彩變幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+。
+2H+。
②含鉻元素的離子在溶液中的顏色:Cr2O![]() (橙色);CrO
(橙色);CrO![]() (黃色);Cr3+(綠色)。
(黃色);Cr3+(綠色)。

(1)i可證明反應Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+的正反應是__________(填“吸熱”或“放熱”)。
+2H+的正反應是__________(填“吸熱”或“放熱”)。
(2)ii是驗證“只降低生成物的濃度,該平衡正向移動”,試劑a是_________。
(3)iii的目的是要驗證“增大生成物的濃度,該平衡逆向移動”,此實驗是否能達到預期目的________(填“能”或“不能”),理由是____________。
(4)根據實驗Ⅱ中不同現象,可以得出的結論是__________。
(5)繼續實驗

①解釋溶液變黃的主要原因是________。
②溶液變綠色,該反應的離子方程式是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】貝諾酯是解熱鎮痛抗炎藥,其結構如圖所示。下列有關說法正確的是

A. 分子式為C17H14O5N
B. 貝諾酯能發生銀鏡反應
C. 1 mol貝諾酯與H2發生加成反應最多消耗8mol H2
D. 在氫氧化鈉水溶液中水解可以得到3種有機物鈉鹽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮(N)、磷(P)、砷(As)等VA族元素化合物在研究和生產中有重要用途。如我國科研人員研究發現As2O3(或寫成As4O6,俗稱砒霜)對白血病有明顯的治療作用回答下列問題:
(1)As原子的核外電子排布式為_________________;P的第一電離能比S大的原因為_______________
(2)寫出一種與CNˉ互為等電子體的粒子________(用化學式表示);(SCN)2分子中σ鍵和π鍵個數比為___________
(3)砒霜劇毒,可用石灰消毒生成AsO33-和少量AsO43-,其中AsO33-中As的雜化方式為__________,AsO43-的空間構型為___________
(4)NH4+中H一N一H的鍵角比NH3中H 一N一H的鍵角大的原因是__________;NH3和水分子與銅離子形成的化合物中陽離子呈軸向狹長的八面體結構(如下圖I),該化合物加熱時首先失去水,請從原子結構角度加以分析:__________
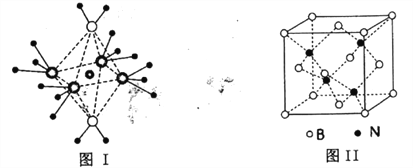
(5)BN的熔點為3000℃,密度為2.25g·cm-3,其晶胞結構如上圖Ⅱ所示,晶體中一個B原子周圍距離最近的N原子有__________個;若原子半徑分別為rNpm和rBpm,阿伏加德羅常數值為NA,則BN晶胞中原子的體積占晶胞體積的百分率為__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳熱還原法廣泛用于合金及材料的制備。回答下列問題:
(1)一種制備氮氧化鋁的反應原理為23Al2O3+15C+5N2==2Al23O27N5+15CO,產物Al23O27N5中氮的化合價為______________________________。
(2)真空碳熱冶鋁法包含很多反應,其中的三個反應如下:
Al2O3 (s)+3C(s)==Al2OC(s)+2CO(g)△H1
2Al2OC(s)+3C(s)==Al4C3(s)+2CO(g)△H2
2Al2O3 (s)+9C(s)== Al4C3 (s)+6CO(g)△H3
①△H3=_________(用△H1、△H2表示)。
②Al4C3可與足量鹽酸反應制備一種最簡單的烴,該反應的化學方程式為__________________________。(3)下列是碳熱還原制錳合金的三個反應,CO與CO2平衡分壓比的自然對數值(1nK=2.303lgK)與溫度的關系如圖所示(已知Kp是用平衡分壓代替濃度計算所得的平衡常數。分壓=總壓×氣體的物質的量分數)。

I.Mn3C(s)+4CO2(g) ![]() 3MnO(s)+5CO(g)Kp(I)
3MnO(s)+5CO(g)Kp(I)
II.Mn(s)+CO2(g) ![]() MnO(s)+CO(g) Kp(II)
MnO(s)+CO(g) Kp(II)
III.Mn3C(s)+CO2(g) ![]() 3Mn(s)+2CO(g)Kp(III)
3Mn(s)+2CO(g)Kp(III)
①△H>0的反應是__________________(填“I”“II”或“I”)。
②1200K時,在一體積為2L的恒容密閉容器中有17.7gMn3C(s)和0.4molCO2,只發生反應I,5min后達到平衡,此時CO的濃度為0.125mol/L,則0~5min內V(CO2)=____________。
③在一體積可變的密閉容器中加入一定量的Mn(s)并充入一定量的CO2(g),只發生反應II,下列能說明反應II達到平衡的是____________(填字母)。
A.容器的體積不再改變 B.固體的質量不再改變 C.氣體的總質量不再改變
④向恒容密閉容器中加入Mn3C并充入0.1molCO2,若只發生反應III,則在A點反應達到平衡。當容器的總壓為akPa時,CO2的轉化率為______________;A點對應溫度下的Kp(III)=____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E為原子序數依次增大的前四周期元素,A是原子半徑最小的元素,B元素有兩個未成對電子,D元素的最外層電子是內層電子數的三倍,E的單質是自然界中最硬的金屬,常用于制作合金,且其未成對電子數在同周期中最多。回答下列問題:
(1)利用原子發生躍遷時吸收或釋放出的光用于鑒定E元素,該方法是________,其價層電子排布圖為____________,根據_____________原理,該基態原子的電子排布應使其能量處于最低狀態。
(2)根據電子排布,C元素處于周期表中_______區;根據元素周期律,電負性B_______C,第一電離能C________D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空間構型是_____________;A與C以原子個數比2:1形成的分子中C原子的雜化方式為_________,它是_________分子(填“極性”或“非極性”),且該分子可以與很多金屬離子形成配合物,其中提供孤對電子的原子是____________(填元素符號)。
(4)生活中常見的B元素的同素異形體有兩種,其結構為圖1、圖2所示:
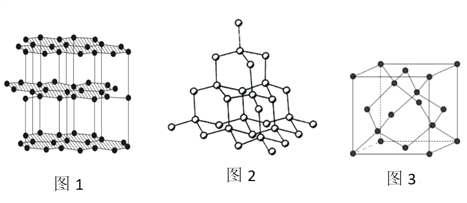
①圖1所對應的同素異形體可以導電,試從其結構予以解釋_________。
②圖2所對應的同素異形體的晶胞如圖3,若B原子的半徑為a nm,則該晶胞的空間利用率為_____________。(![]() =1.732,結果保留一位小數)
=1.732,結果保留一位小數)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com